题目内容
20. 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示.根据判断出的元素回答问题:
(1)f在元素周期表的位置是第三周期ⅢA族.
(2)比较d、e常见离子的半径的小(用化学式表示,下同)O2->Na+;比较g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4.
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
 (或
(或
 ).
).
分析 从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素、z是N元素、d是O元素、e是Na元素、f是Al元素、g是S元素、h是Cl元素,
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,最高价氧化物水化物的酸性越强;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,根据电子式的书写原则写出其电子式.
解答 解:从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
(1)f是Al元素,其原子序数为13,在元素周期表中位于第三周期ⅢA族,
故答案为:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+;非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:O2-;Na+;HClO4;H2SO4;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: (或
(或
 ),
),
故答案为: (或
(或
 ).
).
点评 本题考查了元素周期表与元素周期律的综合应用,题目难度中等,明确原子结构与元素周期表、元素周期律的关系为解答关键,注意掌握离子半径比较方法及电子式的书写原则.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关钠和镁的说法中,不正确的是( )
| A. | 电解饱和食盐水可以得到氯气 | |
| B. | 金属钠在高温下能将TiCl4中的钛置换出来 | |
| C. | 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 | |
| D. | 金属镁着火,可用二氧化碳灭火 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=12的溶液:K+、Na+、CH3COO-、ClO- | |
| B. | 0.1mol•L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol/LFeCl3溶液中:Al3+、NH4+、SCN-、SO42- | |
| D. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、SO42- |
9.关于0.5mol/L CH3COOH与0.5mol/L 盐酸的比较,正确的是( )
| A. | 氢离子浓度相同 | |
| B. | 导电能力相同 | |
| C. | 相同体积时,中和NaOH的能力相同 | |
| D. | 加水稀释10倍后,溶液的pH值均上升1个单位 |
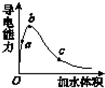 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.
在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题. 如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:
如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则: