题目内容
8. 25℃时,已知:
25℃时,已知:H2CO3?H++HCO3- K1=4.3×10-7
HCO3-?H++CO32- K2=5.6×10-11
H2O?H++OH- KW=1.0×10-14
现取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示.在25℃时,下列有关溶液中离子浓度关系叙述正确的是( )
| A. | W 点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4 的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8 的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11 的溶液中:CO32-+H2O HCO3-+OH- K≈1.8×l0-4 |
分析 10.6g碳酸钠的物质的量为n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,
A.根据电荷守恒判断,阴离子漏掉了氯离子;
B.pH=4时有二氧化碳气体生成,根据物料守恒判断;
C.先判断溶液中的溶质,再根据物料守恒判断;
D.CO32-+H2O?HCO3-+OH-的平衡常数K=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}×\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{{K}_{2}}$及水的离子积、碳酸氢根离子的电离平衡常数计算.
解答 解:10.6g碳酸钠的物质的量为n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,
A.根据电荷守恒可知,溶液中离子浓度应该满足:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-),故A错误;
B.根据图象可知,pH=4时有CO2生成,根据物料守恒可知:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 mol•L-1,故B错误;
C.根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知:c(H2CO3)+c(HCO3-)+c(CO32-)=c(Cl-)=$\frac{1}{2}$c(Na+),再结合电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-)可得:c(H+)+2c(H2CO3)+2c(HCO3-)=c(OH-)+c(Cl-),故C错误;
D.CO32-+H2O?HCO3-+OH-的平衡常数K═$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}×\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{{K}_{2}}$=$\frac{1×1{0}^{-14}}{5.6×1{0}^{-11}}$≈1.8×l0-4,故D正确;
故选D.
点评 本题考查离子浓度大小比较,侧重对学生分析能力的培养,题目难度中等,该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图象和题意灵活运用即可.

 天天向上口算本系列答案
天天向上口算本系列答案| A. | 摩尔是一种物理量 | |
| B. | 溶液中或熔融状态下能导电的物质就是电解质 | |
| C. | 氧化还原反应的本质是元素化合价发生了变化 | |
| D. | 得电子的物质被还原,是氧化剂 |
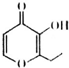 俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C8H8O3 | |
| B. | 1 mo1该有机物最多能与 2 mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物能与碳酸氢钠反应生成CO2 |
| A. | 该溶液中存在两个平衡、七种粒子 | |
| B. | 该溶液中K+、NH4+、NO3-、Al3+可以大量共存 | |
| C. | 滴加少量稀硫酸,充分振荡无现象 | |
| D. | 通入足量SO2气体,发生反应的离子方程式:2S2-+SO2+2H2O═3S↓+4OH- |
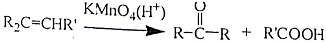 R、R′代表烃基)
R、R′代表烃基)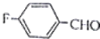 的名称对氟苯甲醛.
的名称对氟苯甲醛.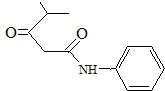 .
.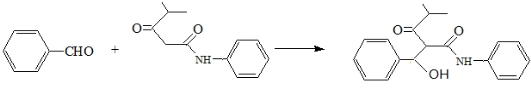 .
. .
.
 .
.