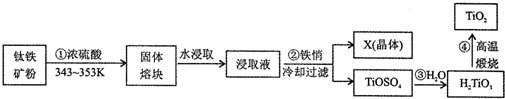
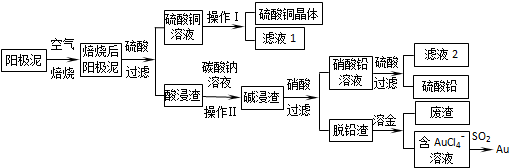
题目内容
3.下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的化合物是( )①NH4HCO3 ②Na2SO4 ③Al2O3 ④Al(OH)3 ⑤Al.
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
分析 中学常见既能与酸又能与碱反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等.
解答 解:①NH4HCO3与氢氧化钠反应生成碳酸钠和氨气、水,与盐酸反应生成氯化铵、二氧化碳和水,故选;
②硫酸钠与氢氧化钠、盐酸都不反应,故不选;
③Al2O3为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,与盐酸反应生成氯化铝和水,故选;
④Al(OH)3 为两性氢氧化物,与氢氧化钠反应生成偏铝酸钠和水,与盐酸反应生成氯化铝和水,故选;
⑤Al与盐酸反应生成氯化铝和氢气,与氢氧化钠反应生成偏铝酸钠和氢气,故选;
故选:A.
点评 本题考查元素化合物性质,掌握物质的性质是关键,侧重对基础知识的巩固,注意归纳总结中学常见能与酸、碱反应的物质,注意两性物质的性质.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
13.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)G元素在周期表中的位置是第四周期第Ⅷ族.
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
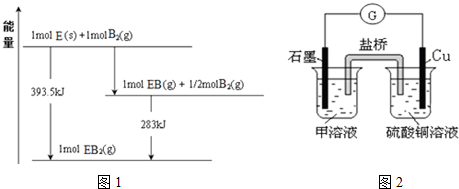
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
11.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是( )
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应,有2 mol电子转移 |
18.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中正确的( )
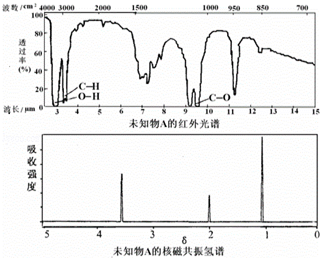

| A. | 由红光外谱可知,该有机物中有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有两种不同化学环境的氢原子 | |
| C. | 仅由核磁共振氢谱即可得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
8.对于有气体参加的化学反应来说,下列说法不正确的是( )
| A. | 压缩容器体积,增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应所需的活化能,活化分子百分数增大,化学反应速率增大 |
13.下列叙述中正确的是( )
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 碱金属元素是指ⅠA族的所有元素 | |
| D. | 副族元素中没有非金属元素 |