题目内容
15.二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.方法一:用TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
请回答下问题:
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O+4HCl.
(2)检验TiO2•xH2O中Cl-是否被除净的方法是取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净.
(3)下列可用于测定TiO2粒子大小的方法是d.
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
方法二:钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、SiO2等杂质,由钛铁矿制取二氧化钛,常用硫酸法,其流程如下,

(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O.
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,适宜的条件还可以选择熔块粉碎(或连续搅拌、适当升高温度等)(任写一种).
(3)浸取液与铁屑反应的离子方程式为2Fe3++Fe=3Fe2+;从滤液中获得晶体X的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在Fe3+离子(填离子符号),检验溶液中还存在Fe2+的方法是取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,则溶液中存在Fe2+(写明步骤、试剂和现象).
(5)写出第③步反应化学方程式TiOSO4+2H2O=H2TiO3+H2SO4.
分析 方法一:(1)根据反应物和生成物结合质量守恒定律来书写化学方程式;
(2)溶液中生成TiO2•xH2O沉淀,固体具有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净;
(3)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小,依此来进行判断;
方法二:钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、SiO2等杂质,在343K-353K条件下钛铁矿和浓硫酸混合,发生的反应有FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,得到固体熔块,然后用水浸取,浸取液中含有Fe3+,Fe3+能和Fe反应生成Fe2+,然后过滤,得到的晶体X成分为硫酸亚铁,TiOSO4能发生水解反应生成H2TiO3和H2SO4,最后高温煅烧得到TiO2,
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,根据反应物和生成物书写方程式;
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,还可以采用升高温度、增大反应物接触面积、搅拌等方法;
(3)铁离子具有氧化性,能被Fe还原;从溶液中得到晶体采用蒸发浓缩、冷却结晶方法;
(4)取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验;
(5)TiOSO4能发生水解反应生成H2TiO3和H2SO4,根据反应物和生成物书写方程式.
解答 解:方法一:
(1)设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O+4HCl;
(2)溶液中生成TiO2•xH2O沉淀,固体有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净,检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在,
故答案为:取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(3)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小,
故答案为:d;
方法二:
钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、SiO2等杂质,在343K-353K条件下钛铁矿和浓硫酸混合,发生的反应有FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,得到固体熔块,然后用水浸取,浸取液中含有Fe3+,Fe3+能和Fe反应生成Fe2+,然后过滤,得到的晶体X成分为硫酸亚铁,TiOSO4能发生水解反应生成H2TiO3和H2SO4,最后高温煅烧得到TiO2,
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,根据反应物和生成物书写方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,
故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,还可以采用升高温度、增大反应物接触面积、搅拌等方法,即采用将熔块粉碎(或连续搅拌、适当升高温度等)方法,
故答案为:熔块粉碎(或连续搅拌、适当升高温度等);
(3)铁离子具有氧化性,能被Fe还原,离子方程式为2Fe3++Fe=3Fe2+;从溶液中得到晶体采用蒸发浓缩、冷却结晶方法,
故答案为:2Fe3++Fe=3Fe2+;蒸发浓缩;冷却结晶;
(4)Fe3+遇KSCN溶液变为血红色,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,
故答案为:Fe3+;取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,则溶液中存在Fe2+;
(5)TiOSO4能发生水解反应生成H2TiO3和H2SO4,方程式为TiOSO4+2H2O=H2TiO3+H2SO4,故答案为:TiOSO4+2H2O=H2TiO3+H2SO4.
点评 本题以物质分离和提纯和制备为载体考查化学工艺流程,涉及离子检验、化学方程式配平、沉淀的洗涤和溶液的配制、滴定操作等知识点,明确化学原理及物质性质是解本题关键,会从整体上分析解答,题目难度中等.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
①NH4HCO3 ②Na2SO4 ③Al2O3 ④Al(OH)3 ⑤Al.
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
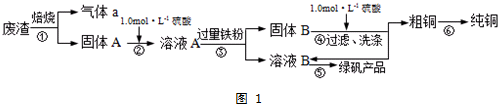
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
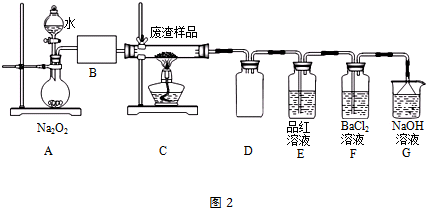
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)

若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:(1)25℃,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14,
(2)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
(3)原料价格表
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO)
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑤中发生的反应是MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑
(4)步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=4×10-8mol/L.
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
(1)二甲醚的核磁共振氢谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚的同分异构体A与浓硫酸混合,加热到170℃时生成有机物B:
①写出A的官能团电子式为
 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;②德国化学家第尔斯和他的学生阿尔德首次发现和记载一种新型反应而获得1950年诺贝尔化学奖,该反应是一种环加成反应:凡含有双键或三键的不饱和化合物,可以和链状或环状含共轭双烯体系发生1,4加成反应,通常生成一个六元环,该反应条件温和,产率很高,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一请根据以上信息写出2-甲基-1,3-丁二烯(含共轭双烯体系)与B反应化学方程式CH2=C(CH3)CH=CH2+CH2=CH2
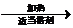
 .
.(3)二甲醚、空气、氢氧化钾溶液、多孔石墨电极构成燃料电池,则负极电极反应式是CH3OCH3+16OH--12e-=2CO32-+11H2O.
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
①比较此时正、逆反应速率的大小:v(正)> v(逆)(填“>”、“<”或“=”);
②若开始只加入CH3OH,经10min后反应达到平衡,计算达到平衡时CH3OH转化率 α(CH3OH)=96.8%(计算结果用百分数表示,保留小数后一位).
 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: