题目内容
13.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
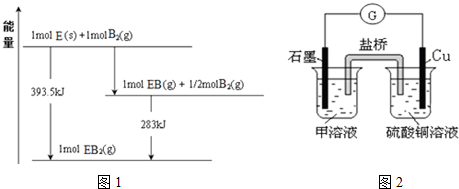
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
分析 A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物能使湿润的红色石蕊试纸变蓝,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,据此解答.
解答 解:A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物能使湿润的红色石蕊试纸变蓝,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素.
(1)G为Fe元素,在元素周期表中位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)N与O可组成质量比为7:16的三原子分子,分子中N原子与氧原子数目之比=$\frac{7}{14}$:$\frac{16}{16}$=1:2,该分子为NO2,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH3应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
点评 本题考查结构性质位置关系应用,涉及元素化合物推断、溶液酸碱性与盐类水解、热化学方程式、原电池等,题目比较综合,需要学生具备扎实的基础与迁移运用能力.

| A. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| B. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| C. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
| A. | 将得到的m g固体放到氧气中充分灼烧后,固体质量变为4.8 g | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | Ba(OH)2溶液吸收CO2后的溶液中有BaCO3和Ba(HCO3)2,且物质的量的比为2:1 | |
| D. | 原混合物中CuO与Fe2O3的质量比为2:1 |
 香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )| A. | 常温下,1mol丁香酚只能与1mol Br2发生反应 | |
| B. | 香兰素分子中至少有12个原子共平面 | |
| C. | 1mol香兰素最多能与3mol氢气发生加成反应 | |
| D. | 丁香酚不能与FeCl3溶液发生显色反应 |
| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
①NH4HCO3 ②Na2SO4 ③Al2O3 ④Al(OH)3 ⑤Al.
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
 .
.