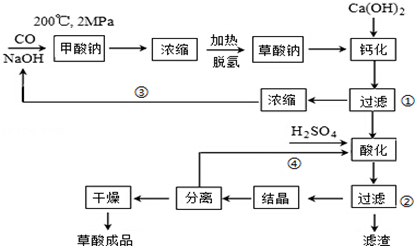
题目内容
12.粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下: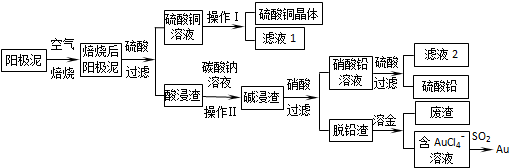
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb-2e-+SO42-=PbSO4和Cu-2e-=Cu2+.
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是将阳极泥粉碎,逆流焙烧等.
(3)操作I的主要步骤为蒸发浓缩,降温结晶,过滤.
(4)写出用SO2还原AuCl4-的离子方程式2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+.
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法用滤液2溶解碱浸渣(或并入硝酸中).
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).
分析 由实验流程可知,粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au.
(1)粗铜中的铜和铅会发生失电子的氧化反应;
(2)阳极泥的成分为Cu、Au(金)和PbSO4 等,在焙烧过程中铜被氧化为CuO,则阳极泥充分的粉碎,增大接触面积可以提高焙烧效率;
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体;
(4)SO2还原AuCl4-反应得到氧化产物是SO42-,还原产物是Au,配平书写方程式;
(5)将滤液1并入硫酸铜溶液进行循环操作,有利于充分利用;
(6)碳酸铅比硫酸铅更加难溶,往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应.
解答 解:粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au.
(1)电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4,
故答案为:Pb-2e-+SO42-=PbSO4;
(2)由题干可知,用于焙烧的阳极泥的成分为Cu、Au(金)和PbSO4 等,在焙烧过程中铜被氧化为CuO,而Au(金)和PbSO4 均较稳定,要使焙烧效率提高,合理措施是把得到的阳极泥充分的粉碎,增大接触面积,或把反应后的气体在次逆流焙烧,这样可以升高温度且减少能耗,
故答案为:将阳极泥粉碎,逆流焙烧等;
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,故答案为:蒸发浓缩,降温结晶,过滤;
(4)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,由氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,则得到的反应方程式为2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+,
故答案为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(5)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,因此类似此处的做法,应该是流程中得到的另一滤液2,此滤液2是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤走硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣;
故答案为:用滤液2溶解碱浸渣 (或并入硝酸中);
(6)比较两种沉淀的溶度积,可知碳酸铅比硫酸铅更加难溶,则往硫酸铅中加入碳酸钠发生沉淀溶解转化,离方程式为PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq),
故答案为:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).
点评 本题考查混合物分离提纯,为高频考点,涉及物质的分离、离子的检验、电解原理、沉淀的转化等知识,把握实验流程及物质的性质为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度较大.

①NH4HCO3 ②Na2SO4 ③Al2O3 ④Al(OH)3 ⑤Al.
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
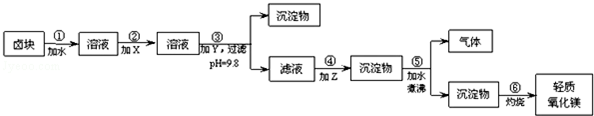
若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:(1)25℃,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14,
(2)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
(3)原料价格表
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO)
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑤中发生的反应是MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑
(4)步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=4×10-8mol/L.
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | 红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化 | |
| C. | 某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸 | |
| D. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
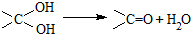 .有机物
.有机物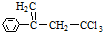 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 可用 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| C. | 在碱性条件下充分水解,可生成羧酸钠 | |
| D. | 在一定条件下可发生聚合反应 |
 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: