题目内容
12.下列物质:①甲醇;②邻甲基苯酚;③甲醛;④甲酸;⑤甲酸钠;⑥甲酸甲酯,在一定条件下能与新制氢氧化铜悬浊液反应生成红色沉淀的是( )| A. | ①②③④ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | 全部都可以 |
分析 含-CHO的有机物与新制的氢氧化铜发生氧化反应,含-COOH的有机物与新制的氢氧化铜发生中和反应,以此来解答.
解答 解:甲醛、甲酸、甲酸酯、甲酸钠等含有醛基,可与新制取氢氧化铜发生氧化反应生成砖红色沉淀,而甲醇、林甲基苯酚与氢氧化铜不能反应生成砖红色沉淀.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握常见有机物的性质、官能团与性质的关系为解答的关键,侧重基础知识的考查,注意常见含有醛基的有机物,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
3.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | CH4 (g)+2 O2(g)═CO2(g)+2 H2O (l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2 O2(g)═CO2(g)+2 H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | CH4(g)+2 O2 (g)═CO2(g)+2 H2O (l)△H=+890.3 kJ•mol-1 |
20.对下列实验的评价,正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO42- | |
| B. | 某无色溶液中滴入紫色石蕊试液显红色,该溶液可能有 CO 32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有 Ba2+ | |
| D. | 验证烧碱溶液中是否含有 Cl-,先加稍过量的稀硝酸除去 OH-,再加入 AgNO3溶液,如有 白色沉淀,则证明有 Cl- |
7.下列各组离子可能大量共存的是( )
| A. | 常温下,c(H+)=1×10-12mol•L-1的溶液中:A13+、Fe3+、SO42-、Cl- | |
| B. | pH=0的溶液中:Fe2+、Ba2+、NO3-、Cl- | |
| C. | 常温下,水电离的c(H+)为1×10-12mol•L-1的溶液中:Na+、NH4+、HCO3-、NO3- | |
| D. | 能使酚酞试液变红色的溶液中:Na+、K+、SiO32-、S2O32- |
17.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:CO2、NO、N2、NH3 | |
| B. | 明矾溶液中:H+、Mg2+、Na+、Cl- | |
| C. | 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、CO32- |
4.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Al | C. | 稳定性:HF>CH4 | D. | 酸性:HClO<HClO4 |
1.除去下列物质中的杂质选用的试剂和方法最合理的是( )
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| B | 苯 | 苯酚 | 氢氧化钠溶液 | 分液 |
| C | 氯化钠溶液 | 碳酸钠 | 氨水、酒精 | 萃取、分液 |
| D | BaSO4 | BaCO3 | 水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
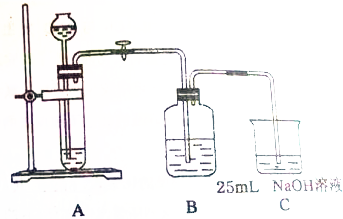 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤: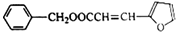 )的合成路线:
)的合成路线:

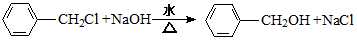 .A+D→E的反应类型为酯化反应.
.A+D→E的反应类型为酯化反应.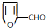 ,其最多有11个原子共平面.
,其最多有11个原子共平面. 与苯环相连;③能够发生水解反应④能够发生银镜反应.
与苯环相连;③能够发生水解反应④能够发生银镜反应.