题目内容
氧化铝与盐酸反应 ;氧化铝与氢氧化钠反应 .
考点:镁、铝的重要化合物,化学方程式的书写
专题:几种重要的金属及其化合物
分析:氧化铝与盐酸反应生成氯化铝和水;氧化铝与氢氧化钠生成偏铝酸钠和水;
解答:
解:氧化铝与盐酸反应生成氯化铝和水,离子方程方程式为:Al2O3+6H+=2Al3++3H2O;
氧化铝与氢氧化钠生成偏铝酸钠和水,离子方程方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-═2AlO2-+H2O;
氧化铝与氢氧化钠生成偏铝酸钠和水,离子方程方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-═2AlO2-+H2O;
点评:本题考查了方程式的书写,题目难度不大,明确物质的性质,了解反应的实质是解题的关键.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
实验中的下列操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 |
| B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中 |
点燃的镁条伸入盛有下列气体的集气瓶中,能继续燃烧的是( )
①Cl2 ②O2 ③CO2 ④水蒸气.
①Cl2 ②O2 ③CO2 ④水蒸气.
| A、① | B、①② | C、①②③ | D、①②④ |
下列实验装置设计正确,且能达到目的是( )
A、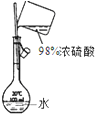 配制稀硫酸溶液 |
B、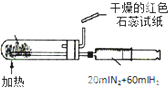 合成氨并检验氨的生成 |
C、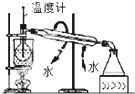 碘的CCl4溶液中分离I2并收回CCl4 |
D、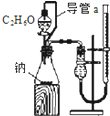 测定乙醇分子结构 |
下列说法正确的是( )
| A、活化分子碰撞即发生化学反应 |
| B、升高温度会加快反应速率,其主要原因是增加了活化分子碰撞的次数 |
| C、有气体参加的化学反应,若增大压强,可增大活化分子百分数,从而使反应速率增大 |
| D、活化分子间的碰撞不一定是有效碰撞 |
 ,若有D和E?XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
,若有D和E?XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为