题目内容
17.如表是周期表中的一部分,根据A-E在周期表中的位置,按题目要求回答.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
(2)A、E两元素的氢化物中最稳定的是HF(填化学式);
(3)C元素的最高价氧化物的化学式是MgO;
(4)B的最高价氧化物的水化物和D的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
分析 由元素在周期表中位置可知,A为F元素、B为Na、C为Mg、D为Al、E为Cl.
(1)同周期自左而右原子半径减小;
(2)非金属性越强,对应氢化物越稳定;
(3)C为Mg元素,最高价为+2;
(4)B的最高价氧化物的水化物为NaOH,D的最高价氧化物为Al2O3,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置可知,A为F元素、B为Na、C为Mg、D为Al、E为Cl.
(1)同周期自左而右原子半径减小,故原子半径:Na>Mg>Al,故答案为:Na>Mg>Al;
(2)非金属性F>Cl,非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>HCl,故答案为:HF;
(3)C为Mg元素,最高价为+2,最高价氧化物化学式为MgO,故答案为:MgO;
(4)B的最高价氧化物的水化物为NaOH,D的最高价氧化物为Al2O3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查元素周期表与元素周期律,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:⑥Si.
(2)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同).
(3)在这12种元素的最高价氧化物对应水化物中,呈两性的氢氧化物是Al(OH)3
(4)在这12种元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同).
(3)在这12种元素的最高价氧化物对应水化物中,呈两性的氢氧化物是Al(OH)3
(4)在这12种元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,.
12.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低.已知反应:BeCl2+Na2BeO2+2H2O═2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
2.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
| A. | CO2(HCl),选用饱和NaHCO3溶液 | |
| B. | NaHCO3溶液(Na2CO3),应通入CO2气体 | |
| C. | Na2O2粉末(Na2O),将混合物在空气中加热 | |
| D. | 镁粉(铝粉),选用过量的烧碱溶液 |
9.科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种.下列关于A的说法正确的是( )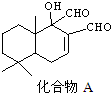

| A. | A的分子式为C15H20O3 | B. | 能发生银镜反应 | ||
| C. | 分子中有3个手性碳原子 | D. | 1molA最多与1molH2完全加成 |
6.下列反应中,既属于氧化还原反应又属于置换反应的是( )
| A. | CuCl2+2NaOH═Cu(OH)2↓+2NaCl | B. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | Cl2+H2O═HCl+HClO |
7.下列说法中,有错误的是( )
| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
