题目内容
7.下列说法中,有错误的是( )| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
分析 A.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠和水;
B.根据碳酸氢钠、碳酸钠的俗名进行解答;
C.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,碳酸钠受热不分解;
D.碳酸钠与盐酸反应先生成碳酸氢钠,然后碳酸氢钠再与盐酸反应生成二氧化碳和水、氯化钠.
解答 解:A.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,Ca2++CO32-=CaCO3↓,碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠和水,HCO3-+OH-+Ca2+=CaCO3↓+H2O,二者都能产生沉淀碳酸钙,故A错误;
B.碳酸氢钠俗称为小苏打,碳酸钠的俗称为纯碱、苏打,故B正确;
C.碳酸氢钠受热分解,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热不分解,故C正确;
D.碳酸钠与盐酸反应先生成碳酸氢钠,然后碳酸氢钠再与盐酸反应生成二氧化碳和水、氯化钠,将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈,故D正确;
故选A.
点评 本题考查了碳酸钠和碳酸氢钠的性质,题目难度不大,明确物质的性质、把握有关化学方程式的计算是解题关键,注意碳酸钠与盐酸反应的原理.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
17.如表是周期表中的一部分,根据A-E在周期表中的位置,按题目要求回答.
(1)B、C、D三元素的原子半径最大的是Na>Mg>Al(填元素符号)
(2)A、E两元素的氢化物中最稳定的是HF(填化学式);
(3)C元素的最高价氧化物的化学式是MgO;
(4)B的最高价氧化物的水化物和D的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
(2)A、E两元素的氢化物中最稳定的是HF(填化学式);
(3)C元素的最高价氧化物的化学式是MgO;
(4)B的最高价氧化物的水化物和D的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
18.下列各组离子在水溶液中一定能大量共存的是( )
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |
12.下列水溶液一定呈中性的是( )
| A. | 由非电解质溶于水得到的溶液 | |
| B. | [H+]、[OH-]均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
19.下列说法正确的是( )
| A. | 25℃时NH4Cl溶液的Kw大于100℃时NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
9.下列说法正确的是( )
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,则△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ•mol-1 |
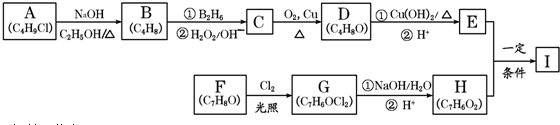
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
. ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol;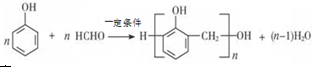 .
.