题目内容
12.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低.已知反应:BeCl2+Na2BeO2+2H2O═2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
分析 在周期表中Be和Al位于对角线位置,性质相似,由反应BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓可知,BeCl2与Na2BeO2发生互促水解生成Be(OH)2,类似于氯化铝与偏铝酸钠的反应.
A.Na2BeO2为强碱弱酸盐,水解呈碱性,将其蒸干,灼烧后可得残留物Na2BeO2;
B.BeCl2为强酸弱碱盐,水解呈酸性,将其蒸干,灼烧后可得残留物BeO;
C.Be(OH)2性质类似于氢氧化铝,具有两性;
D.根据化合物在熔融状态下能否导电来判断其是否是离子化合物,共价化合物在水溶液中也可以导电.
解答 解:A.Na2BeO2溶液水解呈碱性,溶液的pH>7,将其蒸干,水解得到的氢氧化钠又与Be(OH)2反应得到Na2BeO2,灼烧后可得残留物Na2BeO2,故A错误;
B.BeCl2为强酸弱碱盐,水解呈酸性,溶液的pH<7,将其蒸干,HCl挥发,水解彻底,得到Be(OH)2,灼烧后可得残留物BeO,故B正确;
C.Be(OH)2性质类似于氢氧化铝,具有两性,则既能溶于盐酸,又能溶于NaOH溶液,故C错误;
D.在熔融状态下能导电的化合物是否是离子化合物,共价化合物在水溶液中也可以导电,BeCl2水溶液导电性强,不能说明BeCl2是离子化合物,故D错误.
故选B.
点评 本题考查元素周期律及盐类水解的应用,侧重于学生自学能力、知识迁移能力的考查,题目难度中等,注意结合铝的化合物性质解答.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
2.下列有关化学用语或表达正确的是( )
| A. | 三硝酸纤维素脂 | B. | 硬酯酸钠 | ||
| C. | 硝酸苯的结构简式: | D. | NaCl晶体模型: |
3.下列化学方程式或离子方程式正确的是( )
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
17.如表是周期表中的一部分,根据A-E在周期表中的位置,按题目要求回答.
(1)B、C、D三元素的原子半径最大的是Na>Mg>Al(填元素符号)
(2)A、E两元素的氢化物中最稳定的是HF(填化学式);
(3)C元素的最高价氧化物的化学式是MgO;
(4)B的最高价氧化物的水化物和D的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
(2)A、E两元素的氢化物中最稳定的是HF(填化学式);
(3)C元素的最高价氧化物的化学式是MgO;
(4)B的最高价氧化物的水化物和D的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
4.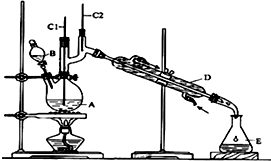 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是冷凝管.
(2)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(3)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出;又可尽量避免其被进一步氧化(或温度过高被氧化为丁酸).
(4)本实验中,正丁醛的产率为51.4%.(保留三位有效数字)
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是冷凝管.
(2)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(3)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出;又可尽量避免其被进一步氧化(或温度过高被氧化为丁酸).
(4)本实验中,正丁醛的产率为51.4%.(保留三位有效数字)
1.下列物质的贮存方法不正确的是( )
| A. | 新制氯水应保存在棕色瓶中 | B. | 少量金属钠保存在煤油中 | ||
| C. | 漂白粉可露置于空气中保存 | D. | 液溴采用液封法保存 |
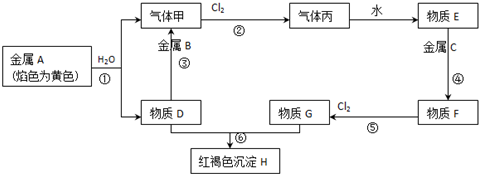
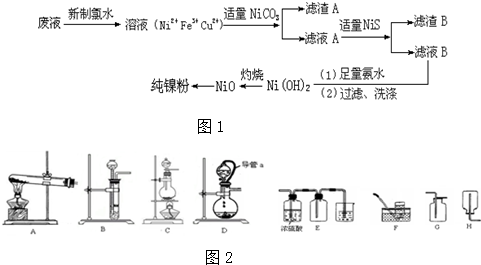
 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol;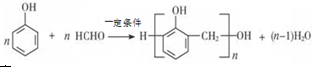 .
.