题目内容
1.写出下列化学方程式(1)2-甲基-2-丙醇的消去反应C(OH)(CH3)3$→_{△}^{浓硫酸}$(CH3)2C=CH2↑+H2O
(2)草酸与乙二醇的缩聚反应nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$
 +(2n-1)H2O
+(2n-1)H2O(3)苯乙烯的加聚反应
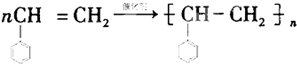
(4)
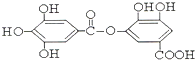 与NaOH的反应
与NaOH的反应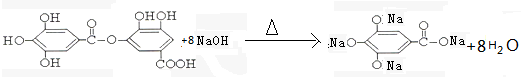
(5)苯甲醛的银镜反应C6H5CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$C6H5COONH4+2Ag↓+3NH3↑+H2O
(6)2,2-二甲基-1-丙醇的去氢氧化2(CH3)3CCH2OH+O2$→_{△}^{铜或银}$2(CH3)3CCHO+2H2O.
分析 (1)2-甲基-2-丙醇在浓硫酸作用下发生消去反应主要生成2-甲基丙烯;
(2)乙二酸和乙二醇之间进行脱水缩聚形成链状高聚物;
(3)苯乙烯在催化剂作用下发生加成反应生成聚苯乙烯,发生的是加聚反应;
(4)酚与碱反应生成酚钠和水,酯在碱性条件下水解生成羧酸钠和水;
(5)醛类可以发生银镜反应生成羧酸铵、金属单质银以及氨气;
(6)醇羟基在首位的醇,催化氧化得到醛.
解答 解:(1)2-甲基-2-丙醇在浓硫酸作用下发生消去反应C(OH)(CH3)3$→_{△}^{浓硫酸}$(CH3)2C=CH2↑+H2O,
故答案为:C(OH)(CH3)3$→_{△}^{浓硫酸}$(CH3)2C=CH2↑+H2O;
(2)乙二酸和乙二醇之间进行脱水缩聚形成链状高聚物,反应的化学方程式为nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O;
+(2n-1)H2O;
故答案为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O;
+(2n-1)H2O;
(3)苯乙烯在引发剂作用下发生加成反应生成聚苯乙烯,发生的是加聚反应,反应的化学方程式为: ,
,
故答案为: ;
;
(4) 结构中含有酚羟基、酯基,
结构中含有酚羟基、酯基, 与NaOH的反应,酯发生水解,酚羟基反应生成酚钠,所以反应的方程式为:
与NaOH的反应,酯发生水解,酚羟基反应生成酚钠,所以反应的方程式为: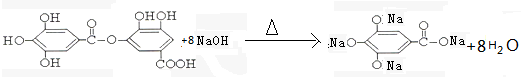 ,
,
故答案为: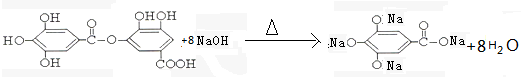 ;
;
(5)苯甲醛含有醛基,能被弱氧化剂银氨试剂氧化,发生银镜反应生成苯甲酸铵、金属单质银以及氨气,即C6H5CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$C6H5COONH4+2Ag↓+3NH3↑+H2O,
故答案为:C6H5CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$C6H5COONH4+2Ag↓+3NH3↑+H2O;
(6)醇发生氧化反应的结构特点是:有羟基所连碳上有氢原子的才能发生氧化反应,醇羟基在首位的醇,催化氧化得到醛,所以2,2-二甲基-1-丙醇在铜或银做催化剂条件下发生催化氧化生成2,2-二甲基-1-丙醛和水,反应的方程式为:2(CH3)3CCH2OH+O2$→_{△}^{铜或银}$2(CH3)3CCHO+2H2O,
故答案为:2(CH3)3CCH2OH+O2$→_{△}^{铜或银}$2(CH3)3CCHO+2H2O.
点评 本题考查有机物化学反应方程式的书写,为高频考点,把握常见有机物的性质及反应类型为解答的关键,注意有机反应条件,题目难度中等.

| A. | X、Y、Z的浓度不再发生变化 | B. | 消耗Z的速率是生成X的速率的2倍 | ||
| C. | 气体总质量保持不变 | D. | X、Y、Z的分子数之比为1:3:2 |
| A. | X元素原子基态时的电子排布式为[Ar]4s24p3 | |
| B. | X元素是第四周期第ⅤA族元素 | |
| C. | Y元素原子的电子排布式为 | |
| D. | Z元素具有两性 |
①FeCl2溶液 ②CuSO4溶液 ③Na2SO3溶液 ④饱和NaOH溶液 ⑤品红溶液.
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①②③④ |

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下.
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8(>8溶解) | 9(>9溶解) |
(2)如果把“调pH=8”和“调pH>11”中间的“过滤”步骤省略,引起的后果是pH>11时Al(OH)3会溶解,引入杂质离子AlO2-,使产品不纯.
(3)流程图中“□”内的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)工业废水中的Na2CrO4遇酸时可转化为Na2Cr2O7,含Cr2O72-的废水毒性较大,为了使废水的排放达标,进行如下处理:

①绿矾化学式为FeSO4•7H20,反应(Ⅰ)的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O.
②若处理后的废水中c(Cr3+)=3.0×10-6mol•L-1,则废水中c(Fe3+)=2×10-13mol•L-1.
(Ksp[Fe(OH)3])=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
(5)某工厂为了测定重铬酸钠样品的纯度,称取重铬酸钠试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,再加入淀粉溶液作指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00ml,则该工厂的重铬酸钠样品的纯度为(设整个过程中其它杂质不参与反应)83.84%.
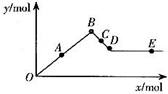 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A. | A~D时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | C~D时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | A~D时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | D~E时溶液中离子的物质的量:Ba2+可能等于OH- |
| A. |  | B. |  | C. |  | D. |  |