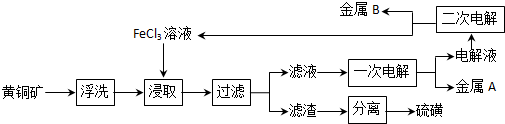
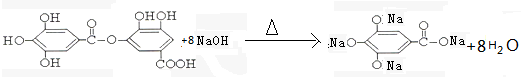题目内容
9.把Na2O2投入到下列溶液中,能够产生沉淀的是( )①FeCl2溶液 ②CuSO4溶液 ③Na2SO3溶液 ④饱和NaOH溶液 ⑤品红溶液.
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①②③④ |
分析 ①Na2O2投入FeCl2溶液反应中Na2O2和水反应,生成的氢氧化钠和氧气,氢氧化钠再与氯化亚铁反应生成氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁;
②过氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀、硫酸钠和水;
③过氧化钠与亚硫酸钠反应生成硫酸钠;
④过氧化钠加入饱和氢氧化钠溶液中,与水反应生成氢氧化钠,产生氢氧化钠沉淀;
⑤过氧化钠具有漂白性,能够使品红褪色.
解答 解:①Na2O2投入FeCl2溶液反应中Na2O2和水反应,生成的氢氧化钠和氧气,氢氧化钠再与氯化亚铁反应生成氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,所以会产生氢氧化铁沉淀,故选;
②过氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀、硫酸钠和水,所以会产生氢氧化铜沉淀,故选;
③过氧化钠与亚硫酸钠反应生成硫酸钠,硫酸钠易溶于水,不会产生沉淀,故不选;
④过氧化钠加入饱和氢氧化钠溶液中,与水反应生成氢氧化钠,产生氢氧化钠沉淀,故选;
⑤过氧化钠具有漂白性,能够使品红褪色,不会产生沉淀,故不选;
故选:C.
点评 本题考查了钠的氧化物的性质,熟悉过氧化钠与盐溶液反应实质及过氧化钠的氧化性是解题关键,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
19.下列指定反应的离子方程式不正确的是( )
| A. | MgO溶于氢碘酸溶液中:MgO+2H+═Mg2++H2O | |
| B. | S与NaOH溶液加热时反应与Cl2相似,其离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | FeSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
17.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X是地壳中含量最多的元素;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | X与W可以形成W2X、W2X2两种化合物 | |
| B. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| C. | X、Y、Z对应氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y、Z两元素的简单离子的半径Y>Z |
19.在一定温度的恒容容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g)═2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的总物质的量 | ||
| C. | 混合气体的平均相对分子质量 | D. | v(B)=3V(D) |




 +(2n-1)H2O
+(2n-1)H2O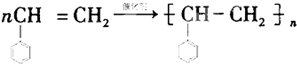
 与NaOH的反应
与NaOH的反应