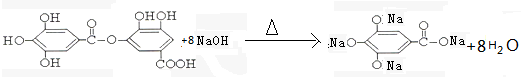题目内容
11.在一定温度下,体积不变的密闭容器中,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )| A. | X、Y、Z的浓度不再发生变化 | B. | 消耗Z的速率是生成X的速率的2倍 | ||
| C. | 气体总质量保持不变 | D. | X、Y、Z的分子数之比为1:3:2 |
分析 A.达到平衡的标志是反应物和生成物组成不再发生变化;
B.化学反应速率之比等于化学方程式计量数之比,消耗Z的速率是生成X的速率的2倍不能说明正逆反应速率相同;
C.反应前后气体质量始终不变;
D.达到平衡ABC的浓度比不一定是1:2:3,浓度比1:2:3,不能说明是否达到平衡;
解答 解:A.由于X、Y、Z的浓度不再变化,说明各种物质的生成速率和消耗速率相等,反应已经达到平衡状态,故A正确;
化学反应速率之比等于化学方程式计量数之比,消耗Z的速率是生成X的速率的2倍不能说明正逆反应速率相同,耗Z的速率是消耗X的速率的2倍,能说明正逆反应速率相同,故B错误;
C.可逆反应X(g)+3Y(g)?2Z(g),反应前后质量始终不变,故C错误;
D.X、Y、Z的分子数之比为1:3:2是反应比,达到平衡ABC的分子数比不一定是1:2:3,不能说明正逆反应速率相等,故D错误;
故选A.
点评 本题考查判断达到化学平衡状态的依据,抓住各组分的浓度不再变化,正反应速率等于逆反应速率,题目难度中等.

练习册系列答案
相关题目
12.过氧乙酸(CH3COOOH)可作为消毒剂,因它具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢.有关过氧乙酸的叙述正确的是( )
| A. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同系物 | |
| B. | 过氧乙酸与苯酚混合使用杀菌能力更强 | |
| C. | 过氧乙酸因具有强氧化性,所以有杀菌作用 | |
| D. | 在使用过氧乙酸消毒时浓度越大越好 |
19.下列指定反应的离子方程式不正确的是( )
| A. | MgO溶于氢碘酸溶液中:MgO+2H+═Mg2++H2O | |
| B. | S与NaOH溶液加热时反应与Cl2相似,其离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | FeSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
6.下列说法不正确的是( )
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
16.现有两种气态烃的混合气体,通过不同实验分别测出下列数据
①1mol该混合烃,在空气中燃烧得到1.5molCO2;
②125℃时,1L某气态烃在9L氧气中充分燃烧反应后的混合气体体积仍为10L(相同条件下);
③0.3moL混和烃完全燃烧生成10.8gH2O;
④相同条件下,该混合烃的密度是氢气的 10倍;
⑤实验测出混合气体中碳原子和氢原子的比值为1:3
⑥60g混合烃完全燃烧生成108gH2O.
上述数据可以直接说明混合烃中一定存在甲烷的是( )
①1mol该混合烃,在空气中燃烧得到1.5molCO2;
②125℃时,1L某气态烃在9L氧气中充分燃烧反应后的混合气体体积仍为10L(相同条件下);
③0.3moL混和烃完全燃烧生成10.8gH2O;
④相同条件下,该混合烃的密度是氢气的 10倍;
⑤实验测出混合气体中碳原子和氢原子的比值为1:3
⑥60g混合烃完全燃烧生成108gH2O.
上述数据可以直接说明混合烃中一定存在甲烷的是( )
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ③④⑤⑥ | D. | ①④⑤⑥ |
3.Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,(填“能”或“不能”)不能判断HA是强酸还是弱酸.
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
Ⅱ.某二元酸(化学式用H2B表示)水溶液电离是:H2B=H++HB- HB-?H++B2-.
回答下列问题:
(6)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是A.
A.c( B2-)+c(HB-)=0.1mol/L
B.c(Na+)=2( c( B2-)+c(HB-)+c(H2B))
C.c(OH-)=c(H+)+c(HB-)+2c(H2B)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)+c( B2-)
| 实验编号 | HA的物质的量浓度(mol•L-1) | NaOH的物质的量浓度(mol•L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
Ⅱ.某二元酸(化学式用H2B表示)水溶液电离是:H2B=H++HB- HB-?H++B2-.
回答下列问题:
(6)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是A.
A.c( B2-)+c(HB-)=0.1mol/L
B.c(Na+)=2( c( B2-)+c(HB-)+c(H2B))
C.c(OH-)=c(H+)+c(HB-)+2c(H2B)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)+c( B2-)
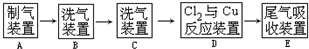
 +(2n-1)H2O
+(2n-1)H2O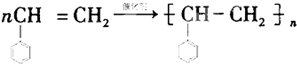
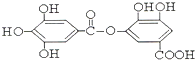 与NaOH的反应
与NaOH的反应