题目内容
18.(1)工业上常用石灰乳吸收工业氯气尾气制得漂白粉,其反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,漂白粉露置于空气中发生变质的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3+2HClO、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2.(2)已知酸性H2CO3>HClO>HCO3-.若向NaClO溶液中通入少量CO2,反应的化学方程式为NaClO+CO2+H2O=NaHCO3+HClO.
分析 (1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;漂白粉露置于空气中时,是次氯酸钙和二氧化碳反应生成碳酸钙和次氯酸,而次氯酸又分解,从而导致变质;
(2)由于酸性H2CO3>HClO>HCO3-,故次氯酸和碳酸根离子反应生成碳酸氢根离子.
解答 解:(1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,化学方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;漂白粉露置于空气中时,是次氯酸钙和二氧化碳反应生成碳酸钙和次氯酸:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,次氯酸不稳定,容易见光分解:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2,导致漂白粉变质,故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3+2HClO; 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2.
(2)由于酸性H2CO3>HClO>HCO3-,故次氯酸和碳酸根离子反应生成碳酸氢根离子,则向NaClO溶液中通入少量CO2的化学方程式为NaClO+CO2+H2O=NaHCO3+HClO,故答案为:NaClO+CO2+H2O=NaHCO3+HClO.
点评 本题考查了化学方程式的书写,比较难的是(2),应注意由于酸性H2CO3>HClO>HCO3-,故次氯酸和碳酸根离子反应生成碳酸氢根离子,和二氧化碳的用量无关.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
8.VL浓度0.5mol/L的盐酸,欲使其浓度增大1倍,可采取的措施是( )
| A. | 通入标准状况下的HCl气体11.2L | |
| B. | 加入10mol/L的盐酸0.1VL,再稀释至1.5L | |
| C. | 将溶液加热浓缩到0.5VL | |
| D. | 加入2mol/L的盐酸VL混合均匀 |
9.水溶液X中只可能溶有Na+、Ca2+、Fe3+、[Al(OH)4]-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶液迸行了如下实验:下列判断正确的是( )
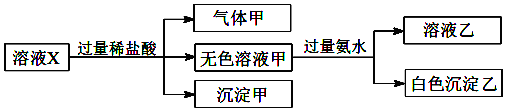

| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | CO32-和SO42-一定不存在于溶液X中 | |
| D. | Na+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
6. 依据事实,写出下列反应的热化学方程式.
依据事实,写出下列反应的热化学方程式.
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol
(2)化学反应N2+3H2?2NH3的能量变化如图所示,试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1
(3)已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
则表中x为463.
 依据事实,写出下列反应的热化学方程式.
依据事实,写出下列反应的热化学方程式.(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol
(2)化学反应N2+3H2?2NH3的能量变化如图所示,试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1
(3)已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
| O═O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
13.下列溶液中微粒浓度关系一定正确的是( )
| A. | 氨水和氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
3.溶解度为S克的某物质的饱和溶液,跟水以1:4的质量比混合后,溶液的质量百分比浓度为( )
| A. | $\frac{80S}{100+S}$×100% | B. | $\frac{S}{100+S}$×100% | C. | $\frac{80S}{100+S}$% | D. | $\frac{20S}{100+S}$% |
10.下列表述错误的是( )
| A. | C3H8分子中的碳原子一定不在同一直线上 | |
| B. | 乙酸与乙醇反应的化学方程式:CH3COOH+C2H518OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O | |
| C. | 用溴水不能区分植物油和矿物油,也不能区分CCl4和苯 | |
| D. | 分子式为C5H12O的有机物在Cu的催化作用下发生催化氧化,但产物不能发生银镜反应的有(不考虑立体异构)3 种 |

