题目内容
8.乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备.
完成下列填空:
(1)实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓硫酸用量又不能过多,原因是浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率.
(2)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解.
(3)实验中加热试管的目的是:①减少乙酸乙酯在水中的溶解;
②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
(4)若用b装置制备乙酸乙酯,其缺点有原料损失较大、易发生副反应.由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,分离乙酸乙酯与该杂质的方法是蒸馏.
分析 (1)制备乙酸乙酯的反应为可逆反应,加入过量的乙醇可提高酯的产率,浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(2)乙醇和乙酸可溶于水,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(3)反应为可逆反应,根据平衡移动原理分析;
(4)b由于不是水浴加热,温度不易控制,饮醋制备乙酸乙酯的缺点有原料损失较大、易发生副反应,由于乙醇溶液发生分子间脱水生成乙醚,乙醚和乙酸乙酯的沸点相差大,可蒸馏分离.
解答 解:(1)由于是可逆反应,由于浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,因此实际用量多于此量;由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率,所以浓硫酸用量又不能过多,
故答案为;浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解,
故答案为:减少乙酸乙酯在水中的溶解;
(3)反应为可逆反应,加热试管的目的是及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动,以及减少乙酸乙酯在水中的溶解,
故答案为:减少乙酸乙酯在水中的溶解;
(4)根据b装置可知由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易发生副反应;由于乙醇溶液发生分子间脱水生成乙醚,所以b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚;乙醚和乙酸乙酯的沸点相差大,则分离乙酸乙酯与该杂质的方法是蒸馏,
故答案为:原料损失较大;乙醚;蒸馏.
点评 本题考查乙酸乙酯的制备,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性以及操作方法,把握实验原理,难度不大.

| A. |  | B. |  | C. |  | D. |  |

| A. | 自然界化合态硫主要以硫铁矿、黄铜矿、石膏、芒硝等形式存在 | |
| B. | 火法炼铜的矿石原料主要含CuS | |
| C. | 该公司炼铜产生的SO2可用于生产H2SO4 | |
| D. | 常温下,18.4 mol/L H2SO4溶液可储存于铁制或铝制容器 |
| A. | 平衡时N2的转化率:α甲>2α乙 | B. | 平衡时NH3的浓度:2c甲<c乙 | ||
| C. | 平衡时体系压强:2p甲>p乙 | D. | 反应放出的热量:2Q甲>Q乙 |
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②设计实验来确定溶液X的成份,请补充完成实验步骤和现象
| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)O2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是d填标号).
a.明矾 b.碘化钾 c.盐酸d.硫酸亚铁.

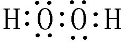 ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程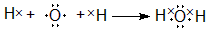 ;
; .
.