题目内容
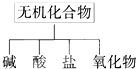 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类:(1)如图所示的物质分类方法名称是
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面;(只需填一种)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O2 |
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树;
(2)酸电离出的阳离子全部是氢离子的化合物;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子;
(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水.
(2)酸电离出的阳离子全部是氢离子的化合物;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子;
(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水.
解答:
解:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,图示方法就是树状图,故答案为:树状分类法;
(2)酸电离出的阳离子全部是氢离子的化合物,如H2SO4;碱电离出的阴离子全部为氢氧根离子,如NaOH;盐电离出得阳离子为金属离子,阴离子为酸根离子,如K2SO4,
故答案为:②H2SO4;④NaOH;⑥K2SO4;
(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O.
(2)酸电离出的阳离子全部是氢离子的化合物,如H2SO4;碱电离出的阴离子全部为氢氧根离子,如NaOH;盐电离出得阳离子为金属离子,阴离子为酸根离子,如K2SO4,
故答案为:②H2SO4;④NaOH;⑥K2SO4;
(3)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O.
点评:本题考查了物质的分类方法和离子方程式的书写,题目难度不大,注意把握相关概念,掌握基础是关键.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA |
| C、标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA |
| D、a mol?L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目为3NA |
化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列实验操作正确的是( )
| A、给试管中的液体加热时,不可将试管口对着自己或旁人 |
| B、蒸馏时,冷水应从冷凝管的上端进入 |
| C、用酒精萃取碘水中的碘 |
| D、分液漏斗中上层液体从漏斗下端流出 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;Z2-离子半径大于W-离子半径;Y是一种重要的半导体材料.下列说法中错误的是( )
| A、元素X、M可形成既含离子键又含共价键的化合物 |
| B、气态氢化物的稳定性:Z<W |
| C、Y元素在自然界中以化合物的形式存在 |
| D、W元素的含氧酸都属于强酸 |
下列离子方程式书写正确的是( )
| A、硫酸铝与氨水反应:Al3++3OH-=Al(OH)3↓ |
| B、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| D、NaHCO3溶液中加入盐酸:H++HCO3-=CO2↑+H2O |
氯化铁溶液和氢氧化铁胶体共同具有的性质是( )
| A、分散质微粒都能透过滤纸 |
| B、都有丁达尔现象 |
| C、加入盐酸后,都先产生沉淀,然后沉淀又溶解 |
| D、都有电泳现象 |
 ;
; .
.
 如图所示,A、B、C、D、E五种物质的相互转化关系
如图所示,A、B、C、D、E五种物质的相互转化关系