题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA |
| C、标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA |
| D、a mol?L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氯气与水的反应是可逆反应;
B、根据CO2和N2O的摩尔质量均为44g/mol来计算;
C、标况下,甲醇为液态;
D、根据Fe3+是弱碱阳离子,在水溶液中会水解来分析.
B、根据CO2和N2O的摩尔质量均为44g/mol来计算;
C、标况下,甲醇为液态;
D、根据Fe3+是弱碱阳离子,在水溶液中会水解来分析.
解答:
解:A、氯气与水的反应是可逆反应,故0.1molCl2溶于水,转移的电子数目小于0.1NA,故A错误;
B、CO2和N2O的摩尔质量均为44g/mol,故22gCO2和N2O的物质的量为0.5mol,而CO2和N2O均为三原子分子,故0.5mol混合气体含1.5mol电子,个数为1.5NA,故B正确;
C、标况下,甲醇为液态,故C错误;
D、Fe3+是弱碱阳离子,在水溶液中会水解导致个数减小,故当Fe3+的数目为 NA,则Cl-的数目大于3NA,故D错误.
故选B.
B、CO2和N2O的摩尔质量均为44g/mol,故22gCO2和N2O的物质的量为0.5mol,而CO2和N2O均为三原子分子,故0.5mol混合气体含1.5mol电子,个数为1.5NA,故B正确;
C、标况下,甲醇为液态,故C错误;
D、Fe3+是弱碱阳离子,在水溶液中会水解导致个数减小,故当Fe3+的数目为 NA,则Cl-的数目大于3NA,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应不能通过一步反应直接完成的是( )
| A、Na2CO3→NaHCO3 |
| B、SiO2→Na2SiO3 |
| C、Al2O3→Al(OH)3 |
| D、Fe(OH)2→Fe(OH)3 |
下列各种应用中,利用了硅元素的还原性的是( )
| A、用硅制造集成电路、晶体管等半导体器件 | ||||
| B、在野外,用硅、石灰、烧碱的混合物制取氢气:Si+Ca (OH)2+2NaOH=Na2SiO3+CaO+2H2↑ | ||||
| C、用HF酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O | ||||
D、单质硅的制备:SiO2+2C
|
pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为( )
| A、11:1 | B、9:1 |
| C、1:11 | D、1:9 |
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA |
| B、22.4L SO2含有NA个SO2分子 |
| C、1.6g CH4所含的电子数为NA |
| D、标况下,4.48L的水中含有H2O分子的数目为0.2NA |
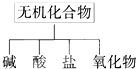 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类: