题目内容
下列离子方程式书写正确的是( )
| A、硫酸铝与氨水反应:Al3++3OH-=Al(OH)3↓ |
| B、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| D、NaHCO3溶液中加入盐酸:H++HCO3-=CO2↑+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.一水合氨为弱电解质,保留化学式;
B.醋酸为弱电解质,应保留化学式;
C.次氯酸为弱电解质,应保留化学式;
D.NaHCO3溶液中加入盐酸,反应生成氯化钠、水和二氧化碳.
B.醋酸为弱电解质,应保留化学式;
C.次氯酸为弱电解质,应保留化学式;
D.NaHCO3溶液中加入盐酸,反应生成氯化钠、水和二氧化碳.
解答:
解:A.硫酸铝与氨水反应,离子方程式:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A错误;
B.碳酸钙溶于醋酸,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.氯气跟水反应,离子方程式:Cl2+H2O=H++Cl-+HClO,故C错误;
D.NaHCO3溶液中加入盐酸,离子方程式:H++HCO3-=CO2↑+H2O,故D正确;
故选:D.
B.碳酸钙溶于醋酸,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.氯气跟水反应,离子方程式:Cl2+H2O=H++Cl-+HClO,故C错误;
D.NaHCO3溶液中加入盐酸,离子方程式:H++HCO3-=CO2↑+H2O,故D正确;
故选:D.
点评:本题考查离子反应方程式书写的正误判断,明确发生的离子反应及离子反应方程式的书写方法即可解答,难度不大.

练习册系列答案
相关题目
常温下,若溶液中由水电离产生的c(H+)=1×10-13mol?L-1,满足此条件的溶液中一定不可以大量共存的离子组是( )
| A、Na+、Al3+、NO3-、SO42- |
| B、K+、Na+、Cl-、HCO3- |
| C、K+、Na+、Cl-、S2- |
| D、K+、NH4+、SO42-、NO3- |
下列有关表述正确的是( )
A、质量数为16的氧原子:
| ||||
| B、纯碱的化学式:NaHCO3 | ||||
C、Mg2+结构示意图: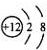 | ||||
D、铁丝在氯气中燃烧的化学方程式:Fe+Cl2
|
将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得沉淀20g,滤液质量比原石灰水减少5.8g,该有机物不可能是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、乙二醇 |
下列关于如图所示有机物的说法中,不正确的是( )


| A、该物质能发生缩聚反应 |
| B、该物质的核磁共振氢谱上共有7个峰 |
| C、该物质能与浓溴水发生反应 |
| D、1mol该物质完全反应最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |

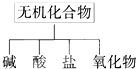 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类: “学生甲”通过中和滴定的方法,去测定在空气中露置一段时间后的NaOH固体的纯度,设计如下方案:
“学生甲”通过中和滴定的方法,去测定在空气中露置一段时间后的NaOH固体的纯度,设计如下方案: