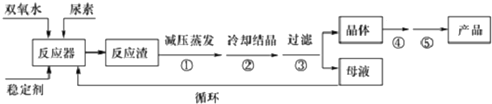
题目内容
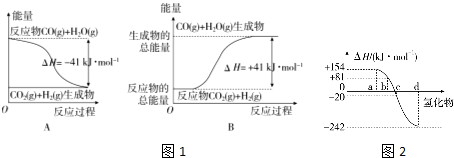
19.(I)已知11g丙烷完全燃烧生成CO2和液态水时放出的热量为555kJ,清写出丙烷燃烧热的热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ•mol-1;(II)已知下列热化学方程式:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
③2C(s)+O2(g)=2CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
回答下列问题:
(1)C的燃烧热为393.5kJ•mol-1;
(2)当18g H2O液态水变成气态水时,△H=+44KJ/mol.
(3)写出表示CO燃烧热的热化学方程式CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-338.25KJ/mol.
分析 (I)先计算出11g丙烷的物质的量,然后根据燃烧热的定义计算出1mol丙烷燃烧放出的热量,据此写出丙烷燃烧的热化学方程式;
(II)(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)依据盖斯定律计算得到;
(3)结合盖斯定律计算得到,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量.
解答 解:(I)11g丙烷的物质的量为$\frac{11g}{44g/mol}$=0.25mol,则1mol丙烷完全燃烧放出的热量为:555kJ×$\frac{1mol}{0.25mol}$=2220kJ,则丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220 kJ•mol-1,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220 kJ•mol-1;
(II)(1)C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,依据燃烧热概念可知碳的燃烧热为393.5kJ•mol-1,故答案为:393.5kJ•mol-1;
(2)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
依据盖斯定律①-②得到H2O(l)=H2O(g)△H=+44KJ/mol,当18gH2O液态水变成气态水时吸热44KJ,
故答案为:+44KJ/mol;
(3)已知:③2C(s)+O2(g)=2CO(g)△H=-110.5kJ•mol-1;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
依据盖斯定律④×2-③得到2CO(g)+O2(g)=2CO2(g)△=-676.5KJ/mol;
CO燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-338.25KJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-338.25KJ/mol.
点评 本题考查了热化学方程式的书写方法,盖斯定律计算应用,燃烧热概念分析判断,题目较简单.

| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2)该反应的正反应为放热反应(“吸热”或“放热”);原因是升高温度平衡常数减小,平衡逆向移动
(3)能判断该反应是否已经达到化学平衡状态的是:D
A.混合气体总的物质的量不变 B.容器中压强不变
C.混合体系中平均摩尔质量不变 D.混合气体中CO浓度不变
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,CO2的平均反应速率;
②3min-4min达到平衡时CO的平衡浓度c3(c3精确到小数点后面三位数).