题目内容
11.现有一瓶无色澄清的溶液,可能由以下离子中的几种组成:Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-,请根据以下实验步骤及现象回答问题:步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体
步骤二:向溶液A加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀和有刺激性气味的气体
步骤三:往B溶液中通入适量Cl2,得到黄褐色溶液C
(1)下列有关该溶液说法正确的是AC.
A.一定存在SO42-、I-、NH4+、SO32- B.一定不存在Fe2+、CO32-、MnO4-
C.可能存在CO32-、Cl-、Na+、K+ D.可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是Cl2+2I-=I2+2Cl-.
(3)若向原溶液中先加入足量的盐酸,再加入足量的Ba(OH)2(填化学式)并加热,通过现象也能得出步骤一、二相同的结论.
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是观察焰色反应如果呈现黄色,含有Na+,透过蓝色钴玻璃观察焰色反应如果呈现紫色,含有K+.
分析 无色溶液可知一定不含Fe2+、MnO4-,
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体,则一定含NH4+;
步骤二:向溶液A加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀和有刺激性气味的气体,则气体为二氧化硫,一定含SO32-,有白色沉淀白色沉淀为硫酸钡,可知一定含SO42-;
步骤三:往B溶液中通入适量Cl2,得到黄褐色溶液C,C中含碘单质,则原溶液一定含I-,以此来解答.
解答 解:(1)A.由上述分析可知,一定存在SO42-、I-、NH4+、SO32-,故A正确;
B.一定不存在Fe2+、MnO4-,故B错误;
C.可能存在CO32-、Cl-、Na+、K+,故C正确;
D.Cl-的检验用AgNO3溶液和HNO3,故D错误;
故答案为:AC;
(2)氯气具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为Cl2+2I-=I2+2Cl-,所以最后溶液颜呈黄褐色;
故答案为:Cl2+2I-=I2+2Cl-;
(3)步骤一加强氧化钠目的是检验NH4+,而Ba(OH)2中也有氢氧根离子同样能检验NH4+,并且提供了氯化钡中钡离子,故答案为:Ba(OH)2;
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是,观察焰色反应如果呈现黄色,含有Na+,透过蓝色钴玻璃观察焰色反应如果呈现紫色,含有K+,
故答案为:观察焰色反应如果呈现黄色,含有Na+,透过蓝色钴玻璃观察焰色反应如果呈现紫色,含有K+.
点评 本题考查无机物的推断,为高频考点,把握离子的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
16.下列关于热化学反应的描述中正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,发生放热反应 | |
| B. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)KJ/mol | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
16.金属铁用途广泛,高炉炼铁的总反应为:Fe2O3 (s)+3CO(g)?2Fe(s)+3CO2(g),请回答下列问题:
(1)已知:
3Fe2O3 (s)+CO(g)?2Fe3O4(s)+CO2(g),△H=-47kJ/mol
Fe3O4 (s)+CO(g)?3FeO(s)+CO2(g),△H=-19kJ/mol
Fe3O4 (s)+CO(g)?Fe(s)+CO2(g),△H=-11kJ/mol
则Fe2O3 (s)+3CO(g)?2Fe(s)+3CO2(g)的)△H=-77kJ/mol.
(2)一定温度下,上述反应的化学平衡常数为8.0,该温度下将2molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向正反应方向进行(填“正”或“逆”或“处于平衡状态”),平衡时CO2的浓度为3.55mol/L;反应达平衡后,若升高温度,平衡常数K将减小(填“增大”“减小”“不变”).
(3)为使反应速率加快,且使反应产率增大,以下条件可行的是C
A.升高温度B.增加三氧化铁的质量C.催化剂+稍低温度
D.用氢氧化钠溶液吸收二氧化碳E.体积收缩增大压强 F.体积恒定增加N2
(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度有关系如下表:
800℃时固体物质的主要成分为Fe3O4、FeO,该温度下若测得固体混合物中m(Fe):m(O)=105:32,Fe3O4被CO还原为FeO的百分率为85.7%(设其它固体杂质中不含Fe、O元素).
(1)已知:
3Fe2O3 (s)+CO(g)?2Fe3O4(s)+CO2(g),△H=-47kJ/mol
Fe3O4 (s)+CO(g)?3FeO(s)+CO2(g),△H=-19kJ/mol
Fe3O4 (s)+CO(g)?Fe(s)+CO2(g),△H=-11kJ/mol
则Fe2O3 (s)+3CO(g)?2Fe(s)+3CO2(g)的)△H=-77kJ/mol.
(2)一定温度下,上述反应的化学平衡常数为8.0,该温度下将2molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向正反应方向进行(填“正”或“逆”或“处于平衡状态”),平衡时CO2的浓度为3.55mol/L;反应达平衡后,若升高温度,平衡常数K将减小(填“增大”“减小”“不变”).
(3)为使反应速率加快,且使反应产率增大,以下条件可行的是C
A.升高温度B.增加三氧化铁的质量C.催化剂+稍低温度
D.用氢氧化钠溶液吸收二氧化碳E.体积收缩增大压强 F.体积恒定增加N2
(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度有关系如下表:
| 温度 | 250℃600℃1000℃2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
3.在复杂的体系中,确认化学反应先后顺序有利于解决问题.下列化学反应先后顺序判断正确的是( )
| A. | 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 在含等物质的量的FeBr2、FeI2溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+ |
20.下列物质中,属于共价化合物的是( )
| A. | NH4Cl | B. | H2O2 | C. | NaCl | D. | I2 |
1.下列物质分子中,各原子不处于同一平面的是:①甲苯;②乙炔;③乙烯;④乙烷;⑤甲烷;⑥苯;⑦丙烯.( )
| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |
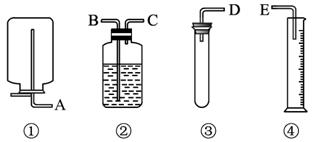 现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,
现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,