题目内容
7. 甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:(i)制备合成气:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.0kJ•mol-1
(ii)合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H2
请回答下列问题:
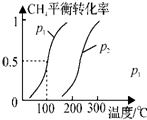
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)=0.0030mol•L-1•min-1.
100℃时该反应的平衡常数K═2.25×10-4;若升高温度,平衡常数K将增大(填“增大”、”“减小”或“不变”).
②图中p1<p2(填“<”、”“>”或“=”).
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:CO2(g)+H2(g)?CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1.
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1molCO(g)和2mol H2(g),发生反应( ii).
①反应( ii)需在低温(填“高温”或“低温”)才能自发进行.
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
分析 (1)①用H2表示的平均反应速率可以根据甲烷的反应速率来求算,根据v=$\frac{△c}{△t}$来计算甲烷的反应速率;根据平衡常数K═$\frac{c(CO)c(H{\;}_{2}){\;}^{3}}{c(CH{\;}_{4})c(H{\;}_{2}O)}$计算,升温平衡正向移动,所以若升高温度,平衡常数K将增大;
②根据压强对化学平衡移动的影响来回答,反应前后气体体积增大,增大压强,化学平衡逆向移动,甲烷的转化率减小;
③①CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH;
(2)①依据反应自发进行的判断依据是△H-T△S<0分析判断;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变.
解答 解:(1)①根据图象数据,用甲烷表示的平均反应速率v=$\frac{△c}{△t}$=$\frac{0.01mol/L×0.5}{5min}$=0.001mol/(L•min),氢气的反应速率是甲烷化学反应速率的3倍,故用H2表示的平均反应速率为0.0030mol•L-1•min-1,
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 2 0 0
转化 0.5 0.5 0.5 0.5
平衡0.5 1.5 0.5 0.5
所以平衡常数K═$\frac{c(CO)c(H{\;}_{2}){\;}^{3}}{c(CH{\;}_{4})c(H{\;}_{2}O)}$=$\frac{\frac{0.5}{100}×(\frac{0.5}{100}){\;}^{3}}{\frac{0.5}{100}×\frac{1.5}{100}}$=2.25×10-4;又升温平衡正向移动,所以若升高温度,平衡常数K将增大;
故答案为:0.0030mol•L-1•min-1;2.25×10-4;增大;
②根据化学方程式可以得出,反应前后气体体积增大,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以从200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
故答案为:<;
③CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH,所以为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1,
故答案为:3:1;
(2)①合成甲醇:CO(g)+2H2(g)?CH3OH(g),反应前后气体体积减小,△S<0,反应是放热反应,△H<0,满足△H-T△S<0,需要在低温下自发进行;
故答案为:低温;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变,反应方程式为Cu2O+CO?2Cu+CO2,
故答案为:Cu2O+CO?2Cu+CO2.
点评 本题考查反应速率概念计算,平衡标志的判断,影响化学平衡、反应速率因素和图象的分析,注意掌握基础知识的掌握,题目难度中等.

| A. | 属于置换反应 | |
| B. | 属于氧化还原反应 | |
| C. | 属于离子反应 | |
| D. | 1molFe参加反应失去的电子数为3NA |
 某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应.下列说法正确的是( )
某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应.下列说法正确的是( )| A. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| B. | 电解F与盐酸反应后的溶液以制取单质A | |
| C. | 反应①、③中消耗相同H2O时反应转移电子数相同 | |
| D. | 工业上常用F的悬浊液与Cl2反应制取漂白粉 |
| A. | Cl2>I2>FeCl3>S | B. | Cl2>FeCl3>I2>S | C. | FeCl3>Cl2>I2>S | D. | S>I2>FeCl3>Cl2 |
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O) |
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体NaOH溶于水
⑤CH3COONa水解
⑥CH3COOH电离.
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①⑤⑥ |
 这种键线式物质是( )
这种键线式物质是( )| A. | 丁烷 | B. | 异丁烷 | C. | 异戊烷 | D. | 新戊烷 |