题目内容
12.6.32g的KMnO4与过量的浓盐酸完全反应,化学方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,回答下列问题:(1)用双线桥标出反应中电子转移的方向和数目并指出反应中的氧化剂、还原剂.
(2)产生的Cl2在标准状况下的体积是多少?
(3)被氧化的HCl的物质的量是多少?
分析 2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,该反应中转移10e-,生成5molCl2,对应10molHCl被氧化,以此来解答.
解答 解:(1)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,HCl为还原剂,该反应中转移10e-,用双线桥标出反应中电子转移的方向和数目为 ,
,
答:用双线桥标出反应中电子转移的方向和数目为 ,KMnO4为氧化剂,HCl为还原剂;
,KMnO4为氧化剂,HCl为还原剂;
(2)n(KMnO4)=$\frac{6.32g}{158g/mol}$=0.04mol,由反应可知,生成氯气为0.04mol×$\frac{5}{2}$=0.1mol,其标况下体积为0.1mol×22.4L/mol=2.24L,
答:产生的Cl2在标准状况下的体积是2.24L;
(3)由Cl原子守恒可知,0.1mol氯气生成时对应0.2 molHCl被氧化,答:被氧化的HCl的物质的量是0.2mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意原子守恒及电子守恒,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
20.下列离子能抑制水的电离的是( )
| A. | H+ | B. | Fe3+ | C. | Na+ | D. | NO3- |
17.下列物质的水溶液,升高温度时pH值变小的是( )
| A. | 氯化铁 | B. | 硫化钠 | C. | 盐酸 | D. | 碳酸钠 |
4.已知反应CO(g)═C(s)+1/2O2(g)的△H为正值,△S为负值.若△H和△S随温度的变化忽略不计,下列说法中正确的是( )
| A. | 低温下反应是自发进行,高温下反应是非自发进行 | |
| B. | 任何温度下反应都是自发进行 | |
| C. | 低温下反应是非自发进行,高温下反应是自发进行 | |
| D. | 任何温度下反应都是非自发进行 |
2.重水(D2O)主要用于核反应堆中中子的减速剂和冷却剂,在化学和生物学中,重水常用作示踪物质来研究反应机理等.下列说法正确的是( )
| A. | D是氢的一种核素,原子核内有2个中子 | |
| B. | 1H218O与D216O的相对分子质量相同 | |
| C. | 3H2O与D2O互称同位素 | |
| D. | 通过化学变化可以直接实现普通水向重水转化 |

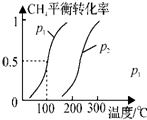 甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇: