题目内容
15.已知反应2FeCl3+2KI=2FeCl2+I2+2KCl,H2S+I2=S+2HI,2FeCl2+Cl2=2FeCl3,由此得出下列微粒氧化性由强到弱的顺序为( )| A. | Cl2>I2>FeCl3>S | B. | Cl2>FeCl3>I2>S | C. | FeCl3>Cl2>I2>S | D. | S>I2>FeCl3>Cl2 |
分析 根据同一反应方程式中,氧化剂的氧化性大于氧化产物的氧化性,判断各物质的氧化性强弱.
解答 解:根据根据同一反应方程式中,氧化剂的氧化性大于氧化产物的氧化性判断.
2FeCl2+Cl2=2 FeCl3,氧化剂是Cl2,氧化产物是FeCl3,所以Cl2的氧化性大于FeCl3的氧化性;
2FeCl3+2KI═2FeCl2+I2+2KCl,氧化剂是FeCl3,氧化产物是I2,所以FeCl3的氧化性大于I2的氧化性;
H2S+I2=S↓+2HI,氧化剂是I2,氧化产物是S,所以I2的氧化性大于S的氧化性;
所以各物质的氧化性大小顺序为:Cl2>Fe3+>I2>S.
故选B.
点评 本题考查了氧化还原反应中氧化性强弱的比较,题目难度不大,注意氧化剂的氧化性大于氧化产物的氧化性.

练习册系列答案
相关题目
6.5.5g某气体中含有7.525×1022个气体分子,则该气体可能为( )
| A. | CO2 | B. | CO | C. | N2 | D. | O2 |
10.关于实验事故或药品的处理方法中,正确的是( )
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加几片碎瓷片 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 |
20.下列离子能抑制水的电离的是( )
| A. | H+ | B. | Fe3+ | C. | Na+ | D. | NO3- |
4.已知反应CO(g)═C(s)+1/2O2(g)的△H为正值,△S为负值.若△H和△S随温度的变化忽略不计,下列说法中正确的是( )
| A. | 低温下反应是自发进行,高温下反应是非自发进行 | |
| B. | 任何温度下反应都是自发进行 | |
| C. | 低温下反应是非自发进行,高温下反应是自发进行 | |
| D. | 任何温度下反应都是非自发进行 |

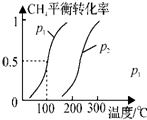 甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇: