题目内容
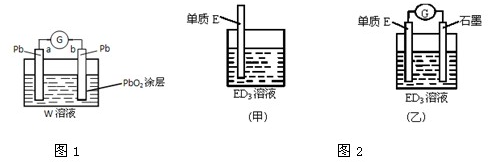
 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
②乙池中阳极的电极反应式是
(2)若两池中均为饱和NaCl溶液:
①甲池中碳极上电极反应式是
②将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为
③若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,则溶液混合匀后的pH=
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)电解NaCl溶液生成NaOH、氢气、氯气;
①甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
②氯气具有强氧化性,能将碘离子氧化生成碘单质,碘遇淀粉试液变蓝色;
③乙池转移0.02mole-,由2e-~2NaOH计算.
(2)电解NaCl溶液生成NaOH、氢气、氯气;
①甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
②氯气具有强氧化性,能将碘离子氧化生成碘单质,碘遇淀粉试液变蓝色;
③乙池转移0.02mole-,由2e-~2NaOH计算.
解答:
解:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,故答案为:碳;
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(2)①甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-,乙中碳为阳极,发生氧化反应,
故答案为:2H2O+O2+4e-═4OH-;氧化反应;
②碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,反应的方程式为Cl2+2KI=I2+2KCl,
故答案为:Cl2+2KI=I2+2KCl;
③乙池总反应方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,由2e-~2NaOH可知,转移0.02mole-,n(NaOH)=0.02mol,c(NaOH)=
=0.1mol/L,所以pH=13,故答案为:13.
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(2)①甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-,乙中碳为阳极,发生氧化反应,
故答案为:2H2O+O2+4e-═4OH-;氧化反应;
②碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,反应的方程式为Cl2+2KI=I2+2KCl,
故答案为:Cl2+2KI=I2+2KCl;
③乙池总反应方程式为2NaCl+2H2O
| ||
| 0.02mol |
| 0.2L |
点评:本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验不能达到预期目的是( )
| A、制备Al2O3:将AlCl3溶液蒸干灼烧 |
| B、制备Fe(OH)3胶体:向沸水中滴加几滴FeCl3饱和溶液继续加热至红褐色 |
| C、检验溶液中是否含有CO32-:向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水 |
| D、比较CH3COO-和CO32-结合H+的能力强弱:相同温度下,测定浓度分别为0.1mol/L的Na2CO3和CH3COONa溶液的pH |
铋(Bi)在医药方面有重要应用.下列关于
Bi和
Bi的说法中,不正确的是( )
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
下列说法正确的是( )
| A、只含非金属元素的离子一定是阴离子 |
| B、某元素由化合态变成游离态一定被还原 |
| C、金属阳离子被还原不一定得到金属单质 |
| D、含金属元素的离子只能是阳离子 |


 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2