题目内容
下表为长式周期表前四周期的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)元素②的基态原子的轨道排布式 ,元素⑩的基态原子的电子排布式为 .
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别对应于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示).

(3)已知A、B、C、D、E均为短周期元素,且原子序数依次增大.A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A原子未成对电子是同周期中最多的.D和E原子的第一至第四电离能如下表所示:
A、B、C三种元素中电负性最大的是 (填写元素符号),D、E两种元素中第一电离能D比较大的原因是 .

请回答下列问题:
(1)元素②的基态原子的轨道排布式
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别对应于晶胞的体心、顶点、面心),则该化合物的化学式为

(3)已知A、B、C、D、E均为短周期元素,且原子序数依次增大.A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A原子未成对电子是同周期中最多的.D和E原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
考点:元素周期表的结构及其应用,元素周期律的作用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)元素②是碳,元素⑩是Cu元素;
(2)晶胞的体心被一个晶胞占有,顶点被8个晶胞分摊、面心被2个晶胞分摊;
(3)A、B、C、D、E均为短周期元素,且原子序数依次增大.B原子p能级电子总数与s能级电子总数相等,核外电子排布为1s22s22p4或1s22s22p63s2,则B为O元素或Mg元素;A、B、C为同一周期的主族元素,A原子未成对电子是同周期中最多的,外围电子排布为ns2np3,由于A的原子序数小于B元素,故B为氧元素、A为N元素,C为氟元素;D原子的第三电离能剧增,表现+2价,处于ⅡA族,E原子的第四电离剧增,表现+3价,处于ⅢA族,故E为Al元素,D为Mg元素,据此解答.
(2)晶胞的体心被一个晶胞占有,顶点被8个晶胞分摊、面心被2个晶胞分摊;
(3)A、B、C、D、E均为短周期元素,且原子序数依次增大.B原子p能级电子总数与s能级电子总数相等,核外电子排布为1s22s22p4或1s22s22p63s2,则B为O元素或Mg元素;A、B、C为同一周期的主族元素,A原子未成对电子是同周期中最多的,外围电子排布为ns2np3,由于A的原子序数小于B元素,故B为氧元素、A为N元素,C为氟元素;D原子的第三电离能剧增,表现+2价,处于ⅡA族,E原子的第四电离剧增,表现+3价,处于ⅢA族,故E为Al元素,D为Mg元素,据此解答.
解答:
解:(1)元素②是碳,基态原子的轨道排布式为
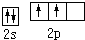 ,元素⑩是Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,
,元素⑩是Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:
 ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;
(2)根据长式元素周期表的结构,②、④、⑨分别为:C、Mg、Ni,分别位于晶胞的体心、顶点、面心,则晶胞中的原子数目之比为:1:(8×
):(6×
)=1:1:3,故答案为:MgCNi3或CMgNi3;
(3)A、B、C、D、E均为短周期元素,且原子序数依次增大.B原子p能级电子总数与s能级电子总数相等,则B的核外电子排布为1s22s22p4或1s22s22p63s2,则B为O元素或Mg元素;A、B、C为同一周期的主族元素,A原子未成对电子是同周期中最多的,则其外围电子排布为ns2np3,由于A的原子序数小于B元素,则A位于第二周期,为N元素;D原子的第三电离能剧增,因此其通常表现+2价,处于ⅡA族,E原子的第四电离剧增,因此其通常表现+3价,处于ⅢA族,可以推出D为Mg元素,E为Al元素,故B为O,A、B、C同周期,则C为F,同周期自左而右电负性增大,故F元素的电负性最大;Mg原子外围电子排布为3s2,s轨道全充满,相对稳定,故第一电离能大于Al元素.
故答案为:F;原子外围电子排布为3s2,s轨道全充满,相对稳定.

 ,元素⑩是Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,
,元素⑩是Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:

 ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;(2)根据长式元素周期表的结构,②、④、⑨分别为:C、Mg、Ni,分别位于晶胞的体心、顶点、面心,则晶胞中的原子数目之比为:1:(8×
| 1 |
| 8 |
| 1 |
| 2 |
(3)A、B、C、D、E均为短周期元素,且原子序数依次增大.B原子p能级电子总数与s能级电子总数相等,则B的核外电子排布为1s22s22p4或1s22s22p63s2,则B为O元素或Mg元素;A、B、C为同一周期的主族元素,A原子未成对电子是同周期中最多的,则其外围电子排布为ns2np3,由于A的原子序数小于B元素,则A位于第二周期,为N元素;D原子的第三电离能剧增,因此其通常表现+2价,处于ⅡA族,E原子的第四电离剧增,因此其通常表现+3价,处于ⅢA族,可以推出D为Mg元素,E为Al元素,故B为O,A、B、C同周期,则C为F,同周期自左而右电负性增大,故F元素的电负性最大;Mg原子外围电子排布为3s2,s轨道全充满,相对稳定,故第一电离能大于Al元素.
故答案为:F;原子外围电子排布为3s2,s轨道全充满,相对稳定.
点评:本题考查结构性质位置关系,综合性较强,难度较大,推断元素是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式的书写正确的是( )
| A、氯化铝溶液中加入过量的氨水 Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| C、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
实验室利用锌和稀硫酸制备氢气,为加快反应速率,可采取措施( )
| A、加入CuSO4粉末 |
| B、加入醋酸钠 |
| C、改用浓硫酸 |
| D、加入硝酸钾 |

 利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化): 海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.


 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: