题目内容
有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
(1)A2B2的结构式为 .
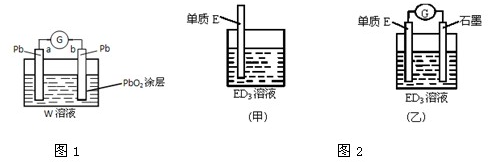
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图1所示).在b电极上发生的反应可表示为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为 .电池工作一段时间后,a极消耗0.05mol Pb,则W的浓度由质量分数39% (密度1.3g/cm3)变为 mol/L.(小数点后保留两位)
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图2甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为 .
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为 .

(1)A2B2的结构式为
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图1所示).在b电极上发生的反应可表示为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图2甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(1)A2B2为H2O2,为共价化合物;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素;
(4)石墨--铁在氯化铁电解质溶液中形成原电池.
(1)A2B2为H2O2,为共价化合物;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素;
(4)石墨--铁在氯化铁电解质溶液中形成原电池.
解答:
解:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素.
(1)A2B2为H2O2,为共价化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4,
已知溶液体积为1L,且H2SO4的浓度由质量分数39% (密度1.3g/cm3),则1L溶液中n(H2SO4)=
=5.17mol,
所以剩余的n(H2SO4)=5.07mol,
则浓度为5.07mol/L,
故答案为:Pb-2e-+SO42-=PbSO4; 5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,在正极上得电子被还原,发生反应为2Fe3++2e-=2Fe2+,
故答案为:2Fe3++2e-=2Fe2+.
(1)A2B2为H2O2,为共价化合物,电子式为
 ,故答案为:
,故答案为: ;
;(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4,
已知溶液体积为1L,且H2SO4的浓度由质量分数39% (密度1.3g/cm3),则1L溶液中n(H2SO4)=
| 1000mL×1.3g/mL×39% |
| 98g/mol |
所以剩余的n(H2SO4)=5.07mol,
则浓度为5.07mol/L,
故答案为:Pb-2e-+SO42-=PbSO4; 5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,在正极上得电子被还原,发生反应为2Fe3++2e-=2Fe2+,
故答案为:2Fe3++2e-=2Fe2+.
点评:本题考查元素推断和电化学知识,考查较为综合,题目难度中等,注意正确推断元素的种类为解答该题的关键.

练习册系列答案
相关题目
关于反应:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O说法不正确的是( )
| A、反应中氧化剂与还原剂物质的量之比为1:2 |
| B、要使8.7g MnO2完全反应,需投入含0.4molHCl的浓盐酸 |
| C、每生成标准状况下2.24L Cl2,就有7.3gHCl被氧化 |
| D、若有0.4molHCl被氧化,反应中转移的电子数为0.4×6.02×1023个 |
某有机物和足量的银氨溶液在微热条件下发生银镜反应,生成10.8克的银,而燃烧等量的有机物时,须消耗氧气6.16升(标准状况),该有机物是( )
| A、葡萄糖 | B、甲酸乙酯 |
| C、丁醛 | D、甲醛 |
 利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化): 海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.


 如图为中学常见物质间的转化关系,其中甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,C常温下为无色液体,B焰色反应为黄色.一些在溶液中进行的反应溶液中的H2O及生成的H2O已省略.回答下列问题:
如图为中学常见物质间的转化关系,其中甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,C常温下为无色液体,B焰色反应为黄色.一些在溶液中进行的反应溶液中的H2O及生成的H2O已省略.回答下列问题: 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: