题目内容
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2(1)属于弱电解质的是
(2)常温下0.01mol/L NaOH溶液的pH=
(3)用离子方程式表示CH3COONa溶液呈碱性的原因
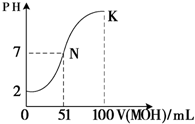
(4)常温下,向100mL 0.01mol?L-1 HA溶液逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
②在滴加过程中,水的电离程度的变化是先
③K点对应的溶液中,c(M+)+c(MOH)=
(5)在25℃下,向浓度均为0.01mol?L-1的FeCl3和CuCl2混合溶液中逐滴加入氨水,先生成
(已知25℃时Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20)
(6)25℃时,将bmol NH4NO3溶于水,向该溶液滴加a L氨水后溶液呈中性,则所滴加氨水的浓度为
考点:酸碱混合时的定性判断及有关ph的计算,强电解质和弱电解质的概念,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)部分电离的电解质是弱电解质,碱或强碱弱酸盐溶液都呈碱性;
(2)c(H+)=
;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=
;
(3)醋酸钠是强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度大小顺序;
(4)①根据溶液的pH和其浓度大小判断;
②酸或碱抑制水电离,含有弱离子的盐促进水电离;
③任何电解质溶液中都存在物料守恒;
(5)溶度积常数小的物质先沉淀,根据溶度积常数结合溶液中氢氧根离子浓度计算c(Cu2+):c(Fe3+);
(6)依据一水合氨的电离平衡常数计算得到氨水浓度.
(2)c(H+)=
| 10-14 |
| c(OH-) |
| 10-14 |
| 10-pH |
(3)醋酸钠是强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度大小顺序;
(4)①根据溶液的pH和其浓度大小判断;
②酸或碱抑制水电离,含有弱离子的盐促进水电离;
③任何电解质溶液中都存在物料守恒;
(5)溶度积常数小的物质先沉淀,根据溶度积常数结合溶液中氢氧根离子浓度计算c(Cu2+):c(Fe3+);
(6)依据一水合氨的电离平衡常数计算得到氨水浓度.
解答:
解:(1)①②⑤⑥是强电解质,③④是弱电解质,⑦⑧是非电解质,碱或强碱弱酸盐溶液呈碱性,所以②④⑤溶液呈碱性,故答案为:③④;②④⑤;
(2)c(H+)=
=
mol/L=10-12 mol/L,所以其pH=12,pH=11的CH3COONa溶液中由水电离产生的c(OH-)═
=
mol/L=1×10-3mol/L,
故答案为:12;1×10-3mol/L;
(3)醋酸钠为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),水解离子方程式为CH3COO?+H2O═CH3COOH+OH?,钠离子不水解,则c(Na+)>c(CH3COO?),醋酸根水解程度较小,所以c(CH3COO?)>c(OH-),则该溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
,故答案为:CH3COO?+H2O═CH3COOH+OH?;c(Na+)>c(CH3COO?)>c(OH-)>c(H+);
(4)①根据图象知,0.01mol/L的HA溶液pH=2,说明HA完全电离为强酸,故答案为:强;
②酸或碱抑制水电离,含有弱离子的盐促进水电离,所以随着反应的进行,水的电离程度先增大后减小,故答案为:增大;减小;
③溶液体积增大一倍,其浓度为原来的一半,根据物料守恒得c(M+)+c(MOH)=0.01mol/L,故答案为:0.01;
(5)溶度积常数越小的越先沉淀,根据溶度积常数知,先生成沉淀的是Fe(OH)3,当溶液的pH=11时,c(OH-)=1×10-3mol/L,c(Cu2+):c(Fe3+)=
:
=5.5×1014,
故答案为:Fe(OH)3;5.5×1014;
(6)在该溶液中,存在电荷守恒:c(NH4+)+(H+)=c(NO3-)+c(OH-),由于溶液为中性,则(H+)=c(OH-),所以c(NH4+)=c(NO3-),由于Kb(NH3?H2O)=2.0×10-5mol/L,即:Kb=
=2.0×10-5mol/L,
设加入的氨水物质的量为n,混合液体积为V,由于c(NH4+)=c(NO3-),相当于溶液中的一水合氨完全来自滴加的氨水,
则c(NH3?H2O)=
=
=
,
解得:n(NH3?H2O)=
mol,
所以滴加的氨水的浓度为:c(NH3?H2O)=
mol/L=
mol/L,
故答案为:
.
(2)c(H+)=
| 10-14 |
| c(OH-) |
| 10-14 |
| 0.01 |
| 10-14 |
| 10-pH |
| 10-14 |
| 10-11 |
故答案为:12;1×10-3mol/L;
(3)醋酸钠为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),水解离子方程式为CH3COO?+H2O═CH3COOH+OH?,钠离子不水解,则c(Na+)>c(CH3COO?),醋酸根水解程度较小,所以c(CH3COO?)>c(OH-),则该溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
,故答案为:CH3COO?+H2O═CH3COOH+OH?;c(Na+)>c(CH3COO?)>c(OH-)>c(H+);
(4)①根据图象知,0.01mol/L的HA溶液pH=2,说明HA完全电离为强酸,故答案为:强;
②酸或碱抑制水电离,含有弱离子的盐促进水电离,所以随着反应的进行,水的电离程度先增大后减小,故答案为:增大;减小;
③溶液体积增大一倍,其浓度为原来的一半,根据物料守恒得c(M+)+c(MOH)=0.01mol/L,故答案为:0.01;
(5)溶度积常数越小的越先沉淀,根据溶度积常数知,先生成沉淀的是Fe(OH)3,当溶液的pH=11时,c(OH-)=1×10-3mol/L,c(Cu2+):c(Fe3+)=
| 2.2×10-20 |
| (10-3)2 |
| 4.0×10-38 |
| (10-3)3 |
故答案为:Fe(OH)3;5.5×1014;
(6)在该溶液中,存在电荷守恒:c(NH4+)+(H+)=c(NO3-)+c(OH-),由于溶液为中性,则(H+)=c(OH-),所以c(NH4+)=c(NO3-),由于Kb(NH3?H2O)=2.0×10-5mol/L,即:Kb=
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
设加入的氨水物质的量为n,混合液体积为V,由于c(NH4+)=c(NO3-),相当于溶液中的一水合氨完全来自滴加的氨水,
则c(NH3?H2O)=
| n |
| V |
| c(NH4+).c(OH-) |
| Kb |
| ||
| 2.0×10-5 |
解得:n(NH3?H2O)=
| b |
| 200 |
所以滴加的氨水的浓度为:c(NH3?H2O)=
| ||
| a |
| b |
| 200a |
故答案为:
| b |
| 200a |
点评:本题考查较综合,涉及酸碱混合溶液定性判断、离子浓度大小比较、盐类水解、电解质的判断、溶度积常数的计算等知识点,根据基本概念结合盐类水解、弱电解质的电离特点来分析解答,难点是(6)题,根据电离平衡常数进行计算即可,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
下列物质的燃烧产物,不会污染空气的是( )
| A、柴油 | B、氢气 | C、硫 | D、煤 |
过量的铁粉与100mL 0.1mol/L的稀盐酸反应,反应速率太快.为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓盐酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 1mol/L的盐酸.
①加H2O ②加NaOH固体 ③滴入过量浓盐酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 1mol/L的盐酸.
| A、①⑥⑦ | B、①④⑤ |
| C、③⑦⑧ | D、③⑥⑦⑧ |
下列装置能达到对应实验目的是( )
A、 收集氨气 |
B、 分离碘和泥沙 |
C、 分离水和苯 |
D、 实验室制取蒸馏水 |



 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下: 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: