题目内容
5.按要求进行计算,直接写出计算结果:(1)32.0g O2和2.0g H2组成的混合气体在标准状况下体积约为44.8L.
(2)等质量的CO与N2所含的原子总数之比为1:1.
(3)将100mL 2.50mol/L BaCl2溶液加水稀释至500mL,所得溶液中Cl-物质的量浓度为1.00mol/L.
分析 (1)根据n=$\frac{m}{M}$计算32.0g O2和2.0g H2的物质的量,再根据V=nVm计算混合气体的体积;
(2)已知M(CO)=28g/mol,M(N2)=28g/mol,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子构成计算;
(3)溶液中离子的浓度=电解质的浓度×一个分子中含有的离子数目;根据稀释前后离子的浓度不变来解答.
解答 解:(1)32.0g O2的物质的量n=$\frac{m}{M}$=$\frac{32g}{32g/mol}$=1mol,2.0g H2的物质的量=$\frac{2g}{2g/mol}$=1mol,故标况下混合气体总体积=(1mol+1mol)×22.4L/mol=22.4L,
故答案为:44.8;
(2)M(CO)=28g/mol,M(N2)=28g/mol,n=$\frac{m}{M}$,等质量的CO与N2所含的物质的量之比为1:1,N2和CO都是双原子分子,根据N=nNA,所含原子总数相等,
即原子总数之比为1:1,
故答案为:1:1;
(3)100ml2.5mol.L-1BaCl2溶液中,Cl-的物质的量浓度为c(Cl-)=2c(BaCl2)=2×2.50mol/L=5.00mol/L;
令稀释后溶液中Cl-的物质的量浓度为c,则:5.00mol/L×100ml=c×500ml,解得c=1.00mol/L,
故答案为:1.00.
点评 本题考查物质的量的有关计算,比较基础,注意掌握以物质的量为中心的计算,注意气体摩尔体积既适用单一气体也适用可以共存的混合气体,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
15.能用H++OH-═H2O表示的是( )
| A. | NaOH溶液和CO2的反应 | B. | Ba(OH)2溶液和稀硫酸的反应 | ||
| C. | NaOH溶液和稀硫酸反应 | D. | 氨水和稀硫酸的反应 |
16.在下列有机物中,能跟溴水发生加成反应,又能被酸性高锰酸钾溶液氧化的是( )
| A. | 乙烯 | B. | 苯 | C. | 甲苯 | D. | 乙烷 |
13.物质X的结构式如图所示,下列关于物质X的说法正确的是( )
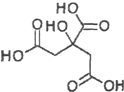

| A. | X分子式为C6H6O7 | |
| B. | X可发生水解反应、加成反应、氧化反应 | |
| C. | X分子内所有碳原子均在同一平面内 | |
| D. | 1mol物质X与足量的Na反应可产生2mol H2 |
20. 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.
(1)工业上制备金属钠的常用方法是电解法.试写出制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.金属钠可用于液态钠可作核反应堆的传热介质 (写出Na在熔点低方面的一种用途).
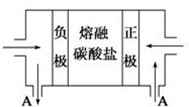
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为O2+4e-+2CO2=2CO32-,电池工作时物质A可循环使用,A物质的化学式为CO2.
②请写出检验Na2CO3中钠元素的方法取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色.
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表:
上述盐溶液的阴离子中,结合H+能力最强的是CO32-,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是c(填序号).
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L-1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(OH-)>c(H+).
②已知几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”).
 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.(1)工业上制备金属钠的常用方法是电解法.试写出制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.金属钠可用于液态钠可作核反应堆的传热介质 (写出Na在熔点低方面的一种用途).
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为O2+4e-+2CO2=2CO32-,电池工作时物质A可循环使用,A物质的化学式为CO2.
②请写出检验Na2CO3中钠元素的方法取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色.
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | .6 | 0.3 | 11.1 |
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L-1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(OH-)>c(H+).
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
10.某溶液中含有Cl-、CO32-、HCO3-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Ca(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加HNO3溶液.
①滴加Ca(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加HNO3溶液.
| A. | ①②④③ | B. | ④①②③ | C. | ③②①②④ | D. | ④③②① |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 在标准状况下,2.24LH2O中原子数为0.3NA | |
| B. | 0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| C. | 16g O2和O3的混合气体中含NA个O原子 | |
| D. | 64克铜与足量的硫反应生成硫化铜,理论上会转移2NA个电子 |
15.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 在ZnS的白色浊液中滴几滴CuSO4溶液 | 探究Ksp(ZnS)和Ksp(CuS)的相对大小 |
| B | 用pH试纸分别测定等浓度的NaF、NaClO溶液的pH | 探究HF与HClO的电离常数 |
| C | 取少量硝酸亚铁溶液,滴加盐酸和KSCN溶液 | 探究硝酸亚铁是否变质 |
| D | 在CH2=CHCH2OH中滴加酸性高锰酸钾溶液,振荡 | 检验丙烯醇是否具有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |