题目内容
9.OPA可用作内窥镜手术用器械抗菌消毒剂,也用于合成新抗血小板聚集药吲哚波芬.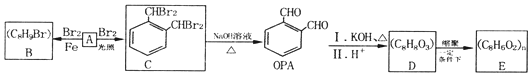
已知:无α-H(醛基相邻碳上的氢)的醛能发生歧化反应,如:2HCHO+KOH$\stackrel{△}{→}$CH3OH+HCOOK由烃A合成OPA的转化关系如图所示.
回答下列问题:
(1)下列关于A的说法正确的是ac(填字母).
a.与苯互为同系物 b.能与溴水发生加成反应
c.能使酸性高锰酸钾溶液褪色 d.能发生加聚反应生成高分子化合物
(2)A→B的反应类型为取代反应.
(3)OPA的化学名称为邻苯二甲醛.
(4)C中所含官能团的名称为溴原子.
(5)E是一种聚酯类高分子化合物,由D生成E的化学方程式为
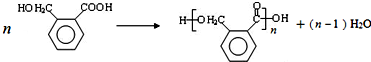 .
.(6)D的同分异构体中,含有苯环且苯环上只有两个取代基,能水解且能与FeC13溶液 发生显色反应的有9种,其中能发生银镜反应且核磁共振氢谱只有5组峰的是
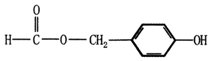 (填结构简式).
(填结构简式).(7)写出以甲苯为原料(其他无机试剂任选)制备苯甲酸苯甲酯的合成路线:
 .
.
分析 A和溴发生取代反应生成C,根据C的结构简式知,A为邻二甲苯,其结构简式为 ,A和溴在铁作催化剂条件下发生取代反应生成B,根据B的分子式知,B的结构简式为
,A和溴在铁作催化剂条件下发生取代反应生成B,根据B的分子式知,B的结构简式为 ,C发生卤代烃的水解反应,再脱水后生成OPA为
,C发生卤代烃的水解反应,再脱水后生成OPA为 ,结合已知反应信息无α-H(醛基相邻碳上的氢)的醛能发生歧化反应可知,邻苯二甲醛反应生成D,D的结构简式为
,结合已知反应信息无α-H(醛基相邻碳上的氢)的醛能发生歧化反应可知,邻苯二甲醛反应生成D,D的结构简式为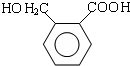 ,E是一种聚酯类高分子化合物,D发生缩聚反应生成E,则E的结构简式为
,E是一种聚酯类高分子化合物,D发生缩聚反应生成E,则E的结构简式为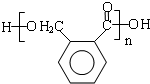 ,据此解答;
,据此解答;
(7)甲苯与氯气在光照条件下得到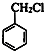 ,在氢氧化钠水溶液、加热条件下水解得到
,在氢氧化钠水溶液、加热条件下水解得到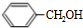 ,甲苯被酸性高锰酸钾溶液氧化得到
,甲苯被酸性高锰酸钾溶液氧化得到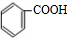 ,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯.
,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯.
解答 解:(1)根据上面的分析可知,A为 ,则与苯互为同系物,能使酸性高锰酸钾溶液褪色,不能与溴水发生加成反应,也不能发生加聚反应生成高分子化合物,故答案为:ac;
,则与苯互为同系物,能使酸性高锰酸钾溶液褪色,不能与溴水发生加成反应,也不能发生加聚反应生成高分子化合物,故答案为:ac;
(2)A和溴在铁作催化剂条件下发生取代反应生成B,则A→B的反应类型为取代反应,故答案为:取代反应;
(3)根据上面的分析可知,OPA为 ,化学名称为邻苯二甲醛,故答案为:邻苯二甲醛;
,化学名称为邻苯二甲醛,故答案为:邻苯二甲醛;
(4)由C的结构简式得出C中官能团的名称是溴原子,故答案为:溴原子;
(5)D的结构简式为 ,则由D生成E的化学反应方程式为
,则由D生成E的化学反应方程式为 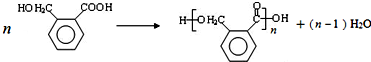 ,
,
故答案为: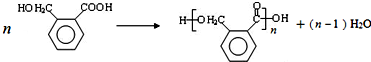 ;
;
(6)D为 ,D的同分异构体中含有苯环且苯环上只有两个取代基,能水解且能与FeC13溶液发生显色反应,即一个取代基为-OH,一个含酯基,则可能为-OH和-CH2OOCH,或-OH、-OOCCH3,或-OH、-COOCH3,分别有邻间对三种,共有9种;其中能发生银镜反应且核磁共振氢谱只有5组峰的是
,D的同分异构体中含有苯环且苯环上只有两个取代基,能水解且能与FeC13溶液发生显色反应,即一个取代基为-OH,一个含酯基,则可能为-OH和-CH2OOCH,或-OH、-OOCCH3,或-OH、-COOCH3,分别有邻间对三种,共有9种;其中能发生银镜反应且核磁共振氢谱只有5组峰的是 ,
,
故答案为:9; ;
;
(7)甲苯与氯气在光照条件下得到 ,在氢氧化钠水溶液、加热条件下水解得到
,在氢氧化钠水溶液、加热条件下水解得到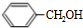 ,甲苯被酸性高锰酸钾溶液氧化得到
,甲苯被酸性高锰酸钾溶液氧化得到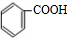 ,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯,合成路线流程图为:
,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团结构与性质、限定条件的同分异构体书写等,注意掌握有机物官能团的性质和转化,结合反应条件与有机物结构进行分析,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案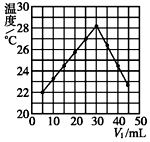 将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )
将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )| A. | 该实验表明所有化学反应化学能只转化为热能 | |
| B. | NaOH溶液的浓度为1.0mol•L-1 | |
| C. | 该实验提供的数据能粗略计算出中和热 | |
| D. | 该实验可分多次把NaOH溶液倒入盛有盐酸的小烧杯中 |
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 镀锌制品镀层破损后,该铁制品比受损前更容易生锈 | |
| C. | 水中加入少量氯化铁固体,溶液中水的电离平衡会向右移动 | |
| D. | pH=3的盐酸与pH=10的某碱溶液等体积混合溶液呈碱性,说明该碱为强碱 |
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
| A. | NH3极易溶于水,可用于工业制冷剂 | |
| B. | 木炭具有还原性,可用于冰箱和居室除臭剂 | |
| C. | Al2O3是两性氧化物,可用于制造高温材料 | |
| D. | Na、K合金熔点低且导热,可用于快中子反应堆的导热剂 |
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
| A. | 碱性 | B. | 还原性 | C. | 氧化性 | D. | 漂白性 |
Ⅰ通过硫代硫酸钠与硫酸反应的有关实验,研究反应速率的影响因素,实验过程数据记录如下.
实验序号 | 反应温度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/(mol•L-1) | V/ml | c/(mol•L-1) | V/ml | ||
| A | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 5 | 0.1 | 5 | 0.1 | 10 |
(2)A和B的组合比较,所研究的问题是温度对化学反应速率的影响.
(3)在上述实验中,反应速率最慢的是(填实验序号)C.
Ⅱ对Na2S2O3的其他部分性质进行了理论预测以及实验探究(反应均在溶液中进行).
| 预测 | 实验操作 | 实验现象 | ?现象解释 | |
| 探究① | Na2S2O3溶液呈碱性 | 溶液pH=8 | S2O32-+H2O HS2O3-+OH- | |
| 探究② | Na2S2O3有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 氯水颜色变浅 |
(5)产生探究②中的现象的原因是(用离子方程式表示)S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
Ⅲ查阅资料发现,在照片冲印过程中,要将曝光后的底片浸泡在过量Na2S2O3溶液中,Na2S2O3可以和涂在胶片上的Ag+反应形成可溶性的无色离子[Ag(S2O3)2]3-,从而起到定影的作用.
该组同学想验证这一过程,于是A同学将Na2S2O3溶液滴至AgNO3溶液中,发现立即生成白色沉淀,他马上停止了实验.一段时间后,发现沉淀逐渐变为黑色,过滤.他认为黑色物质可能是Ag2O或Ag2S.
B同学在A同学分析、实验的基础上分析过滤所得滤液,发现滤液中除含未反应完的AgNO3外,只含有少量Na+和SO42-.
(6)B同学认为根据以上分析,即能判断黑色物质是Ag2S.请简述B同学做出如上判断的理由是溶液中有SO42-,说明有硫元素升价,所以体系中必须有元素降价.若生成Ag2O,体系中无元素降价;所以只能是有一部分硫元素降为-2价,生成Ag2S..
(7)A同学未能验证定影过程的原因可能是定影过程要求将Ag+与过量Na2S2O3溶液反应生成可溶性的无色离子[Ag(S2O3)2]3-(Na2S2O3过量,而A同学将Na2S2O3溶液滴至AgNO3溶液中(AgNO3过量),由于反应物的比例关系不同,因此反应现象不同.