题目内容
3.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
分析 A.若46g气体全为NO2,计算NO2分子数,若46g气体全为N2O4,计算N2O4分子数;
B.常温常压下,Fe遇到浓硝酸发生钝化;
C.缺少溶液的体积,无法计算微粒个数;
D.乙醇分子表示为C2H4•H2O,耗氧部分为C2H4.
解答 解:A.若全为NO2,物质的量为$\frac{46g}{46g/mol}$=1mol,若全为N2O4,物质的量为$\frac{46g}{92g/mol}$=0.5mol,实际为混合气体,且存在2NO2?N2O4,则46g的NO2和N2O4混合气体含有的分子数小于NA,故A错误;
B.常温常压下,Fe遇到浓硝酸发生钝化,所以0.1molFe投人足量的浓硝酸中,转移的电子数少于0.3NA,故B错误;
C.25℃,pH=11的Na2CO3溶液中由水电离出的H+的浓度为10-3mol/L,但缺少溶液的体积,因此所含H+的数目无法计算,故C错误;
D.0.1molC2H4完全燃烧所消耗O2的分子数为0.3NA,乙醇分子表示为C2H4•H2O,耗氧部分为C2H4,所以0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数相同,故D正确;
故选D.
点评 本题考查阿伏伽德罗常数的计算,为高频考点,涉及元素及其化合物的性质、烃及其衍生物耗氧量的计算等知识,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | NH3极易溶于水,可用于工业制冷剂 | |
| B. | 木炭具有还原性,可用于冰箱和居室除臭剂 | |
| C. | Al2O3是两性氧化物,可用于制造高温材料 | |
| D. | Na、K合金熔点低且导热,可用于快中子反应堆的导热剂 |
11.下列说法不正确的是( )
| A. | 煤和石油燃烧不完全时可排放出大量烟尘和CO | |
| B. | 化石燃料燃烧排出废气中含SO2,直接排到大气中会污染空气并形成酸雨 | |
| C. | 可通过物理方法把化石燃料转化为洁净燃料 | |
| D. | 氢能、核能、太阳能等都属于洁净、高效的新能源 |
18.SO2不具有的性质是( )
| A. | 碱性 | B. | 还原性 | C. | 氧化性 | D. | 漂白性 |
8.下列关于有机化合物的说法正确的是( )
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
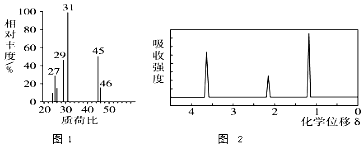
 (填结构简式)
(填结构简式)
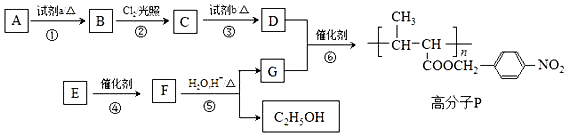
 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$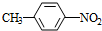 +H2O.
+H2O.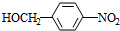 +
+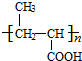 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +nH2O.
+nH2O.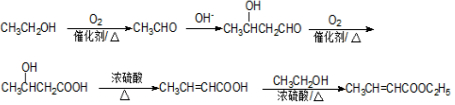 .
.