题目内容
5.新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )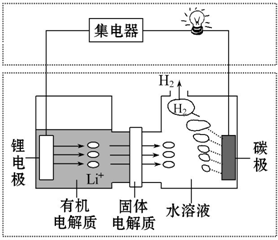
| A. | 碳极发生的反应:2H2O+2e-═H2↑+2OH- | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 理论上外电路中每转移1 mol电子,负极消耗的质量为7 g | |
| D. | 若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 |
分析 因锂与水反应,则形成原电池时锂为负极,碳为正极,且负极不能与水接触,负极反应为Li-e-=Li+,正极反应为2H2O+2e-=H2↑+2OH-,结合电极方程式解答该题.
解答 解:A.碳极上产生氢气,应该是正极,反应中水为氧化剂,氧气不参加反应,正极方程式为2H2O+2e-=H2↑+2OH-,故A正确;
B.由于金属Li可以和水之间反应生成氢氧化锂和氢气,但是和有机电解质不反应,所以有机电解质通过固体电解质不可进入水溶液中,故B正确;
C.理论上,外电路中每转移1mol电子,由Li-e-=Li+可知消耗1moLi,质量为7g,故C正确;
D.充电时,锂电极发生还原反应生成Li,应连接电源负极,故D错误.
故选D.
点评 本题考查新型电池,为高频考点,侧重于学生的分析能力的考查,题目难度不大,解答本题的关键是根据物质的性质判断电极反应,并能书写有关反应的离子方程式.

练习册系列答案
相关题目
15.铜的冶炼大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法不正确( )
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法不正确( )
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6molCuFeS2制取6molCu时共消耗15molO2 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6 | |
| D. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 |
16.化学与人类社会生产、生活密切相关,下列说法正确的是( )
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
13.化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及生物质能的利用 | |
| C. | 煤的主要成分为单质碳、苯、二甲苯等,因而可通过煤的干馏将它们分离 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
20.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
10.下列有关实验的操作、现象和结论或解释 都正确的是( )
| 选项 | 操作 | 现象 | 结论或解释 |
| A | 用pH计或pH试纸分别测定饱和SO2水溶液和饱和CO2水溶液的pH值 | 饱和SO2水溶液的pH值小于饱和CO2水溶液 | 亚硫酸强于碳酸 |
| B | 向加热KClO3制氧气后的残余固体中加入浓H2SO4,继续加热 | 产生黄绿色气体 | 浓硫酸与残渣中的KCl发生反应生成了Cl2 |
| C | 加热装在试管中的NH4Cl晶体 | 试管底部的晶体消失,试管上部有晶体凝结. | NH4Cl晶体发生了升华. |
| D | 将一根较粗的铜丝在酒精灯火焰上加热到红热,然后趁热插入乙醇中一会儿取出. | 铜丝先变黑后又变红,乙醇中伴有刺激性气味产生. | 铜丝发生了几个反应,但铜丝前后的质量不变. |
| A. | A | B. | B | C. | C | D. | D |
17.以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.下列说法正确的是( )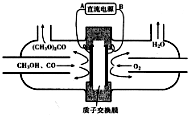

| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
14. 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
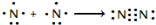 .
.
(2)联氨(N2H4)是一种还原剂.已知:H2O(l)=H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
(3)KCN可用于溶解难溶金属卤化物.将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为:AgI(s)+2CN-(aq)?Ag(CN)2-(aq)+I-(aq).若已知Ksp(AgI)=1.5×10-16,K稳[Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K=1.5×10-37.(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
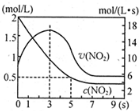
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如下.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
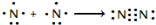 .
.(2)联氨(N2H4)是一种还原剂.已知:H2O(l)=H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如下.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
15.用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)作为标准液来滴定.造成测定结果偏高的原因可能是( )
| A. | 用固体氢氧化钠配制标准溶液时其中混有Na2O杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现碱式滴定管尖嘴处悬挂一滴溶液 |