题目内容
13.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A、D同主族,C、E同主族,D、E、F同周期.A、B的原子最外层电子数之和与C原子的最外层电子数相等.A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子(题中的字母只代表元素代号,与实际元素符号无关).请回答下列问题:
(1)A~F六种元素原子,原子半径最大的是Na(填对应的元素符号).
(2)A与B两种元素组成一种阳离子,该离子符号为NH4+.
(3)C、D两种元素组成的化合物的化学式是Na2O或Na2O2.
(4)E、F两种元素中非金属性较强的是Cl,能够证明这一结论的化学事实是高氯酸的酸性比硫酸的酸性强.
分析 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,则A为H元素,C为O元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,D、E、F同周期,则D为Na,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素,结合元素周期律解答.
解答 解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,则A为H元素,C为O元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,D、E、F同周期,则D为Na,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述A~F六种元素原子,原子半径最大的是Na,故答案为:Na;
(2)A与B两种元素组成一种阳离子,该离子符号为NH4+,故答案为:NH4+;
(3)C、D两种元素组成的化合物的化学式是Na2O、Na2O2,故答案为:Na2O、Na2O2;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>S,能够证明这一结论的化学事实是:高氯酸的酸性比硫酸的酸性强,
故答案为:Cl;高氯酸的酸性比硫酸的酸性强.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素的推断是解题的关键,A与C形成的化合物常温下为液态是推断突破口,注意掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
4.对下面有机物的叙述不正确的是( )
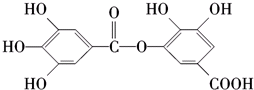

| A. | 常温下 可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5 mol 该物质完全反应可以消耗4 mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
1.含有一个双键的烯烃,和氢气加成后的产物结构简式如图,则此烯烃可能有的结构有( )


| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
8.食品香精菠萝酯的生产路线(反应条件略去)如图,下列叙述错误的是( )

| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 苯酚和菠萝酯均可与KMnO4酸性溶液发生反应 | |
| C. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| D. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 |
18.在碘水中加入适量的CCl4振荡后,观察到的现象为( )
| A. | 上层液体呈紫红色 | B. | 下层液体呈褐色 | ||
| C. | 上层液体呈深褐色 | D. | 下层液体呈紫红色 |
2.阿伏伽德罗常数用NA表示,下列说法正确的是( )
| A. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g | |
| B. | 1molC5H12分子中碳碳之间共用的电子对数为5NA | |
| C. | 电解Na2SO4溶液,在阴极区增加2molH+ 时消耗电子数为2NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,放出46kJ热量转移电子数3NA |
3.下列四种基本类型的反应中,一定是氧化还原反应的是( )
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
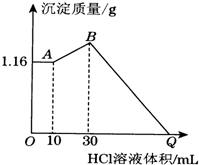 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答: