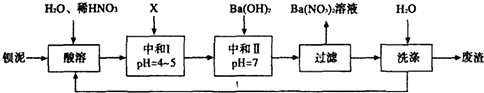
题目内容
1.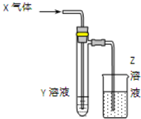 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气微溶于水,应用氢氧化钠溶液吸收;
B.二氧化碳和氨气生成碳酸铵,可与氯化钡反应生成沉淀;
C.石蕊先变红后变为蓝色;
D.应在加热的条件下反应.
解答 解:A.氯气微溶于水,应用氢氧化钠溶液吸收,不能用水,否则污染环境,故A错误;
B.二氧化碳和氨气生成碳酸铵,可与氯化钡反应生成沉淀,氨气为碱性气体,可用硫酸吸收尾气,故B正确;
C.通入二氧化硫,溶液呈酸性,石蕊先变红,后加入氢氧化钠,中和后溶液呈碱性时石蕊变为蓝色,不存在褪色的现象,故C错误;
D.醛与氢氧化铜浊液的氧化还原反应应在加热的条件下进行,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、实验装置及尾气处理等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性及实验装置的分析,题目难度不大.

练习册系列答案
相关题目
11.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
12.氯气是一种化学性质很活泼的非金属单质,下列叙述中不正确的是( )
| A. | 能使潮湿的有色布条褪色 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
6.化学是以实验为基础的科学,以下说法正确的是( )
| A. | 用硫酸酸化高锰酸钾溶液,能起到增强氧化性作用 | |
| B. | 向某溶液中加入稀NaOH溶液未能产生使湿润的红色石蕊试变蓝的气体,说明原溶液中不含NH4+ | |
| C. | 在坩埚中加热MgCl2•6H2O晶体可以得到无水MgCl2 | |
| D. | 向某溶液中加入稀盐酸能产生使品红溶液褪色的气体,说明原溶液中一定含有SO32- |
11.在 溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+、MnO4-、Na+、Cl- | B. | Fe3+、Na+、Cl-、SO42- | ||
| C. | Na+、H+、NO3-、SO42- | D. | K+、Na+、NO3-、Cu2+ |
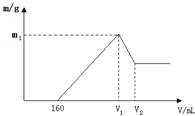 将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题: