题目内容
6.化学是以实验为基础的科学,以下说法正确的是( )| A. | 用硫酸酸化高锰酸钾溶液,能起到增强氧化性作用 | |
| B. | 向某溶液中加入稀NaOH溶液未能产生使湿润的红色石蕊试变蓝的气体,说明原溶液中不含NH4+ | |
| C. | 在坩埚中加热MgCl2•6H2O晶体可以得到无水MgCl2 | |
| D. | 向某溶液中加入稀盐酸能产生使品红溶液褪色的气体,说明原溶液中一定含有SO32- |
分析 A.酸性条件下,高锰酸钾具有强氧化性;
B.氨气易溶于水;
C.加热时氯化镁易水解;
D.可能为HSO3-等.
解答 解:A.酸性条件下,高锰酸钾具有强氧化性,用硫酸酸化,可增大高锰酸钾的氧化性,注意不能用盐酸,故A正确;
B.氨气易溶于水,直接加热稀氢氧化钠溶液不能得到氨气,应用氢氧化钠浓溶液且加热,故B错误;
C.加热时氯化镁易水解,应在氯化氢氛围中加热,故C错误;
D.能使品红褪色的不一定为二氧化硫,且生成二氧化硫的也不一定为SO32-,也可能为HSO3-等,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的检验,盐类水解以及物质的性质等,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握的性质以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | 天然气的主要成分是甲烷,它属于不可再生能源 | |
| B. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| C. | 石油分馏得到的汽油、煤油、柴油等都有混合物,没有固定的熔沸点 | |
| D. | 石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
17.在温度不变的条件下,恒定的容器中进行下列反应:N2O4?2NO2,若N2O4的浓度由0.1mol/L降到0.07mol/L要用10s,那么N2O4的浓度从0.07mol/L降到0.04mol/L时,所用时间( )
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
14.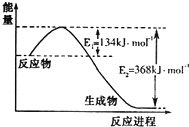 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①比较K1、K2的大小:K1> K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC (填序号).
A.2vH2(正)=3vNH2(逆) B.3vH2(正)=2vH2(正)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的排列顺序正确的是AC (填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)═c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1) | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1> K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC (填序号).
A.2vH2(正)=3vNH2(逆) B.3vH2(正)=2vH2(正)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的排列顺序正确的是AC (填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)═c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
1. 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
11.如图操作或装置能达到实验目的是( )
| A. |  除去氯气中的HCl气体 | |
| B. | 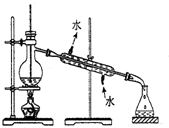 分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. | 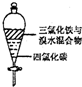 可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色 | |
| D. | 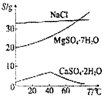 溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
15.用下列分离装置进行相应实验,能达到相应实验目的是( )


| A. | 用图I除去CO2中含有的少量Cl2 | |
| B. | 用图Ⅱ蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 用图Ⅲ分离NaCl和Na2SO4的混合溶液 | |
| D. | 用图Ⅳ分离CCl4萃取碘水中的碘后已分层的有机层和水层 |


 .
.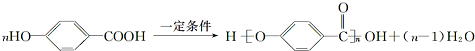 .
.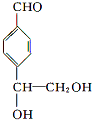 等.
等.