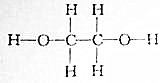
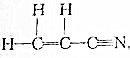题目内容
12.氯气是一种化学性质很活泼的非金属单质,下列叙述中不正确的是( )| A. | 能使潮湿的有色布条褪色 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
分析 A、潮湿的有色布条中的水与氯气反应生成次氯酸;
B、钠与氯气反应生成氯化钠固体;
C、氢气不纯点燃容易发生爆炸,需要纯净的氢气能在Cl2中安静地燃烧发出苍白色火焰生成氯化氢;
D、由Cl2+H2O?HClO+HCl,次氯酸见光易分解生成盐酸和氧气来分析.
解答 解:A、潮湿的有色布条中的水与氯气反应生成次氯酸,所以有色布条褪色,故A正确;
B、钠与氯气反应生成氯化钠固体,所以生成白色的烟,故B正确;
C、纯净的H2在Cl2中安静地燃烧生成HCl,观察到苍白色火焰,生成的氯化氢遇到水蒸气在集气瓶口呈现雾状,而不是烟雾,故C错误;
D、氯气能与水反应生成HClO和HCl,次氯酸见光易分解生成盐酸和氧气,促进了氯气与水反应完全,久置氯水最终变为稀盐酸,故D正确;
故选C.
点评 本题考查氯气的化学性质,明确氯气与金属、非金属、与水的反应即可解答,特别注意次氯酸的性质应用.

练习册系列答案
相关题目
2.下列事实不能用元素周期律解释的是( )
| A. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | |
| D. | 气态氢化物的稳定性:HBr>HI |
3.理论上下列反应不能设计成原电池反应的是( )
| A. | 2Fe3++Cu═2Fe2++Cu2+ | B. | Zn+2H+═Zn2++H2↑ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
7.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 氨气可做制冷剂 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 包装食品里常有硅胶、生石灰、还原铁粉等,其作用相同 |
17.在温度不变的条件下,恒定的容器中进行下列反应:N2O4?2NO2,若N2O4的浓度由0.1mol/L降到0.07mol/L要用10s,那么N2O4的浓度从0.07mol/L降到0.04mol/L时,所用时间( )
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
1.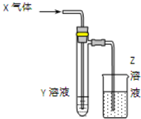 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
2.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )
| A. |  用如图所示装置制取少量H2 | |
| B. |  用如图所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. |  用如图所示装置制取少量Cl2 | |
| D. |  用如图所示装置确定导线中有电流通过及并确定电流方向 |