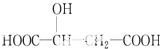题目内容
13.在反应3BrF3+5H2O═HBrO3+9HF+Br2+O2↑中氧化剂是BrF3,还原剂是BrF3、H2O;若有10.8g水参加反应,则被水还原的BrF3的物质的量是0.16.分析 氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物,得电子化合价降低的元素被氧化.
解答 解:3BrF3+5H2O→HBrO3+Br2+O2+9HF中,溴元素的化合价由+3价变为0价和+5价,氧元素的化合价由-2价变为0价,所以氧化剂是BrF3,还原剂是BrF3和H2O,氧化产物是HBrO3、O2,还原产物是Br2,水的物质的量为n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,
由方程式可知若有5mol H2O参加反应,则有2mol水被氧化,0.6mol的水参加反应有0.24mol被氧化,失去电子的物质的量为0.48mol,
令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则0.48mol=xmol×(3-0),
x=0.16mol,故答案为:BrF3;BrF3、H2O;0.16.
点评 本题考查氧化还原反应的计算、氧化还原反应基本概念,难度中等,关键根据化合价判断氧化剂、还原剂,利用电子转移守恒、元素守恒计算.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
3.理论上下列反应不能设计成原电池反应的是( )
| A. | 2Fe3++Cu═2Fe2++Cu2+ | B. | Zn+2H+═Zn2++H2↑ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
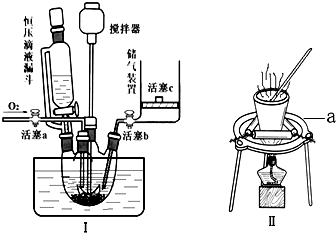
1.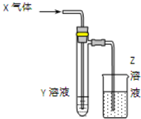 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
8.氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等.回答下列问题:
(1)可用纯碱、焦炭、氨气反应制取 NaCN,同时还有水生成,写出反应的化学方程式,并标明电子转移的方向和数目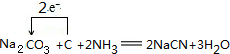 ;
;
(2)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na(二氰合金酸钠)溶液,再用锌还原 Na生成金,“浸取”反应的还原产物是NaOH;
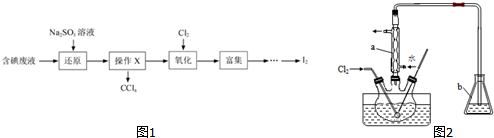
(3)如图1为用含NaCN的废水合成黄血盐(K4Fe(CN)6)的主要工艺流程如图:

已知相同温度下溶解度:Na4Fe(CN)6>K4Fe(CN)6
①实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
②在转化罐中发生反应的化学方程式为Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓.
③加入碳酸钠溶液主要目的是除去过量的Ca2+.
④“操作”环节具体为过滤、洗涤、干燥.
(4)CN -可以造成水体污染,某小组用如下方法对此污水进行处理如图2装置模拟电化学法处理CN -,有关结果如表.
①若乙池中石墨(I)极产生无毒无害的物质,其电极反应式为2CN-+12OH--10e-=2CO32-+N2+6H2O;
②该实验表明电化学法处理CN-时,影响处理速率的因素有负极的金属材料、甲中电解质氯化钠的浓度以及氧气的浓度(任答两点)
(1)可用纯碱、焦炭、氨气反应制取 NaCN,同时还有水生成,写出反应的化学方程式,并标明电子转移的方向和数目
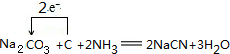 ;
;(2)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na(二氰合金酸钠)溶液,再用锌还原 Na生成金,“浸取”反应的还原产物是NaOH;
(3)如图1为用含NaCN的废水合成黄血盐(K4Fe(CN)6)的主要工艺流程如图:

已知相同温度下溶解度:Na4Fe(CN)6>K4Fe(CN)6
①实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
②在转化罐中发生反应的化学方程式为Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓.
③加入碳酸钠溶液主要目的是除去过量的Ca2+.
④“操作”环节具体为过滤、洗涤、干燥.
(4)CN -可以造成水体污染,某小组用如下方法对此污水进行处理如图2装置模拟电化学法处理CN -,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度(mol/L) | 甲中石墨表面通人气体 | 电流计读数(A) |
| (1) | Fe | 0.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
②该实验表明电化学法处理CN-时,影响处理速率的因素有负极的金属材料、甲中电解质氯化钠的浓度以及氧气的浓度(任答两点)
2.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )
| A. |  用如图所示装置制取少量H2 | |
| B. |  用如图所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. |  用如图所示装置制取少量Cl2 | |
| D. |  用如图所示装置确定导线中有电流通过及并确定电流方向 |
 .
.