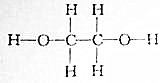
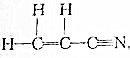题目内容
9. 将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:
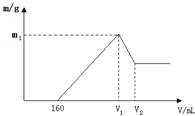
将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:(1)若在滴加NaOH溶液的过程中,产生沉淀的质量m随加入NaOH溶液的体积变化如图所示,则
V1=400mL,V2=440mL,m1=6.6g.
(2)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol/L硫酸溶解后,再加入450mL1mol/L氢氧化钠溶液,所得溶液无Al(OH)3沉淀.满足此条件的a的取值范围是0.5≤a<1.
分析 (1)滴加NaOH溶液到体积V1mL时,沉淀量最大,此时溶液中溶质为Na2SO4,根据钠离子与硫酸根守恒有n(NaOH)=2n(Na2SO4)=2n(H2SO4),进而计算V1;
开始滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,令MgSO4为xmol,Al2(SO4)3为ymol,结合Mg、Al物质的量转化以及硫酸根守恒计算各自物质的量,当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al),据此求出n(NaOH),进而计算V2;
根据元素守恒可知氢氧化镁、氢氧化铝的物质的量,再根据m=nM计算沉淀质量;
(2)反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定a的取值范围.
解答 解:(1)滴加NaOH溶液到体积V1mL时,沉淀量最大,此时溶液中溶质为Na2SO4,根据钠离子与硫酸根守恒有n(NaOH)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,故V1=$\frac{0.4mol}{1mol/L}$=0.4L=400mL,
当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.16L×1mol/L=0.08mol,
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.1×2-0.08
联立方程,解得:x=0.06、y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L+0.04mol=0.44mol,所以,V2=$\frac{0.44mol}{1mol/L}$=0.44L=440mL,
由原子守恒可知氢氧化镁为0.06mol,氢氧化铝为0.04mol,则m1=0.06mol×58g/mol+0.04mol×78g/mol=6.6g,
故答案为:400;440;6.6;
(2)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.45×1≥2×0.1×2+0.1(1-a),解得a≥0.5,故0.5≤a<1,
故答案为:0.5≤a<1.
点评 本题以图象形式考查混合物计算,关键是清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合守恒思想进行解答,较好地考查学生分析计算能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
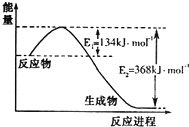 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1) | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1> K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC (填序号).
A.2vH2(正)=3vNH2(逆) B.3vH2(正)=2vH2(正)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的排列顺序正确的是AC (填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)═c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
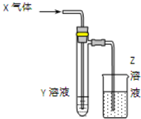 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
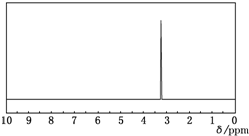
| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3-O-CH3 | D. | CH3CHO |