题目内容
4. 磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:(1)上述元素中,位于第二周期的元素第一电离能由大到小的顺序为F>O>C.
(2)请写出两种CO的等电子体的化学式N2、CN-.
(3)Si晶体中存在与金刚石结构类似的晶体,其中原子与原子之间以共价键
相结合,其晶胞中共有8个Si原子,其中在面心位置贡献3个Si原子.SiF4虽然也是硅的化合物,但是沸点比Si02低很多.原因是:SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键
(4)白磷在空气中燃烧的一种生成物分子的结构如图1所示.其中圆圈表示原子,实线表示化化学键.分子中P原子的杂化方式为sp3.
(5)如图2为一种磷的硫化物的结构,有关该物质的说法中正确的是AD
A.该物质的化学式为P4S3
B.该物质分子中含有σ键和π键
C.该物质中P元素的化合价为+3价
D.该物质的晶体中每个分子的配位数为12
(6)Ca元素位于周期表的s区,基态钙原子的电子排布式为1s22s22p63s23p64s2,Ca单质为面心立方晶体,一个晶胞中含4个Ca原子,已知Ca原子的半径为174pm列式表示Ca单质的密度$\frac{4×40}{6.02×1{0}^{23}×(2\sqrt{2}×174×1{0}^{-10})^{3}}$g•cm-3(不必计算出结果).
分析 (1)上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素;
(2)原子总数相等、价电子总数相等的微粒互为等电子体;
(3)Si晶体中存在与金刚石结构类似的晶体,属于原子晶体,硅原子与氧原子之间形成共价键;晶胞中有4个Si原子处于晶胞体内体积,其它Si原子处于面心、顶点上;
SiF4属于分子晶体,SiO2属于原子晶体,故二氧化硅的沸点较高;
(4)图中形成2个共价键的原子为O原子,形成3个共价键的原子为P原子,P原子还有1对孤对电子,P原子杂化轨道数目为4;
(5)A.根据原子形成化学键数目可知,白色球为S原子、黑色球为P原子;
B.该分子中不含π键;
C.根据化合价代数和为0计算;
D.属于分子晶体,为面心立方最密堆积;
(6)Ca元素原子外围电子排布为4s2,原子核外有20个电子,根据能量最低原理书写电子排布式;
Ca单质为面心立方晶体,一个晶胞中含Ca原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{40}{{N}_{A}}$g,Ca原子的半径为174pm,则晶胞棱长为4×174×10-10 cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$×174×10-10 cm,计算晶胞体积,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
故答案为:F>O>C;
(2)原子总数相等、价电子总数相等的微粒互为等电子体,与CO的等电子体的微粒为N2、CN-等,
故答案为:N2、CN-;
(3)Si晶体中存在与金刚石结构类似的晶体,属于原子晶体,硅原子与氧原子之间形成共价键;晶胞中有4个Si原子处于晶胞体内,其它Si原子处于面心、顶点上,在面心位置贡献Si原子数为6×$\frac{1}{2}$=3;
SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键,故二氧化硅的沸点较高,
故答案为:共价键;3;SiF4属于分子晶体,熔化时破坏范德华力,SiO2属于原子晶体,熔化时破坏共价键;
(4)图中形成2个共价键的原子为O原子,形成3个共价键的原子为P原子,P原子还有1对孤对电子,P原子杂化轨道数目为4,分子中P原子的杂化方式为sp3,
故答案为:sp3;
(5)A.根据原子形成化学键数目可知,白色球为S原子、黑色球为P原子,则该化合物化学式为P4S3,故A正确;
B.该分子中不含π键,故B错误;
C.根据化合价代数和为0,可知P4S3中P的平均化合价为$\frac{2×3}{4}$=+1.5,故C错误;
D.属于分子晶体,为面心立方最密堆积,配位数为12,故D正确,
故选:AD;
(6)Ca元素原子外围电子排布为4s2,处于周期表中s区,原子核外有20个电子,核外电子排布式式为:1s22s22p63s23p64s2,Ca单质为面心立方晶体,一个晶胞中含Ca原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{40}{6.02×1{0}^{23}}$g,Ca原子的半径为174pm,则晶胞棱长为4×174×10-10 cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$×174×10-10 cm,则晶胞密度=4×$\frac{40}{6.02×1{0}^{23}}$g÷(2$\sqrt{2}$×174×10-10 cm)3=$\frac{4×40}{6.02×1{0}^{23}×(2\sqrt{2}×174×1{0}^{-10})^{3}}$g/cm3,
故答案为:s;1s22s22p63s23p64s2;4;$\frac{4×40}{6.02×1{0}^{23}×(2\sqrt{2}×174×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及电离能、等电子体、晶胞结构与计算、化学键、杂化方式、熔沸点高低比较等,需要学生具备扎实的基础与灵活应用能力,难度中等,注意识记中学常见晶胞结构.

| A. | 用Na、Mg分别与冷水反应的实验来证明Na、Mg的金属性强弱 | |
| B. | 用MgCl2和AlCl3分别与过量氨水反应的实验证明Mg、Al的金属性强弱 | |
| C. | 用MgCl2和AlCl3分别与过量NaOH溶液逐步反应的实验证明Mg、Al的金属性强弱 | |
| D. | 用Mg(OH)2和Al(OH)3分别与强碱反应的实验来证明Mg、Al的金属性强弱 |
| A. | 常温时,在水中的溶解性:碳酸钠>碳酸氢钠 | |
| B. | 热稳定性:碳酸钠<碳酸氢钠 | |
| C. | 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠 | |
| D. | 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠 |
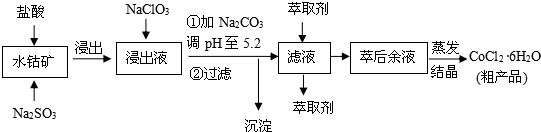
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH表:(金属离子浓度为:0,01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
| A. | 钠钾合金比纯钠的熔点高 | |
| B. | 鉴别碳酸氢钠中含有纯碱的方法是加热看是否有气体生成 | |
| C. | Fe2O3可以用作红色油漆或涂料 | |
| D. | Cl2具有漂白性 |
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |