题目内容
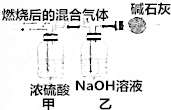
18.下列说法或表示方法中正确的是( )| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+02(g)=2H20(1)△H=-285kJ•mol-1 | |
| B. | 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多 | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023 | |
| D. | 已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,放出的热量要小于57.3kJ |
分析 A.氢气燃烧的热化学方程式中氢气的化学计量数应为1;
B.等质量的气态硫具有的能量大于固态硫;
C.氮气与氢气的反应为可逆反应;
D.浓硫酸溶解会放出热量.
解答 解:A.氢气的燃烧热为285.8kJ•mol-1,氢气的燃烧热热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,故A错误;
B.等质量的气态硫具有的能量大于固态硫,所以等质量的硫蒸气和硫粉分别完全燃烧,前者放出的热量多,故B错误;
C.氮气与氢气的反应为可逆反应,氮气和氢气不能完全反应,则某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023,故C正确;
D.已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,由于浓硫酸溶解会放出热量,所以放出的热量要大于57.3kJ,故D错误.
故选C.
点评 本题考查了反应热和焓变、燃烧热的热化学方程式的书写以及物质的能量与状态的关系等,题目综合性较强,难度不大,注意把握可逆反应的特点,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
8.关于苯的叙述中错误的是( )
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯在一定条件下能与氢气发生加成反应 | |
| D. | 苯分子是单双键交替的环状结构 |
9.与“实验操作”相对应的“实验现象”的字母代号填入答案栏中
| 实验操作 | 答案 | 实验现象 |
| (1)将浓硫酸滴在小木条上 | A.产生白烟 | |
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 | B.溶液褪色 | |
| (3)在盛有KI淀粉溶液的试管中滴加氯水 | C.溶液呈红色 | |
| (4)在盛有FeCl3溶液的试管中滴入2滴KSCN溶液 | D.产生棕红色气体 | |
| (5)铜丝放到浓硝酸中 | E.变黑色 | |
| (6)铜丝放入热的浓硫酸溶液中,将生成气体通入品红溶液中 | F.产生蓝色物质 |
6.下列各组顺序的排列不正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 | |
| D. | 熔点:SiO2>NaCl>Na>CO2 |
13.将NaOH溶液滴入FeCl2溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
7.下列说法正确的是( )
| A. | 淀粉遇到KI溶液呈现特殊蓝色 | |
| B. | 淀粉和纤维素属于多糖,其分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖一般不溶于水,没有甜味,没有还原性 | |
| D. | 在稀硫酸作用下,淀粉水解生成葡萄糖和果糖 |
18.氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )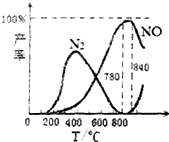
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )

| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
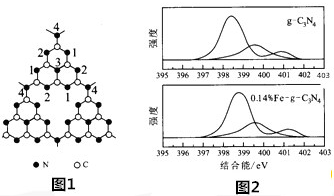 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移. .
.