题目内容
12.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
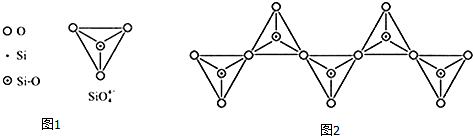
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).
分析 (1)原子中,离原子核越远的电子层其能量越高;该原子中含有3个s轨道、6个p轨道;
(2)硅属于亲氧元素,在自然界中主要以二氧化硅和硅酸盐存在;
(3)非金属元素之间易形成共价键;利用均摊法计算;
(4)可使湿润的红色石蕊试纸变蓝的气体是氨气,再根据元素守恒知还生成氯化镁MgCl2;
(5)①键能越大形成的键越稳定;
②键能越大形成的化学键越稳定,键能越小越不稳定;
(6)利用均摊法计算其原子个数比,从而确定其化学式.
解答 解:(1)原子中,离原子核越远的电子层其能量越高,所以Si原子中M电子层能量最高;该原子中含有3个s轨道、6个p轨道,所以一共有9个轨道,电子数为4,
故答案为:M;9;4;
(2)硅属于亲氧元素,在自然界中不能以单质存在,主要以二氧化硅和硅酸盐存在,故答案为:二氧化硅;
(3)硅单质中硅硅之间以共价键结合,硅晶胞中每个顶点上有1个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,面心提供的硅原子个数=6×$\frac{1}{2}$=3,
故答案为:共价键;3;
(4)可使湿润的红色石蕊试纸变蓝的气体是氨气,再根据元素守恒知还生成氯化镁MgCl2,所以反应方程式为:Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2,
故答案为:Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2;
(5)①键能越大形成的化学键越稳定,C-C键和C-H键的键能大于Si-Si键和Si-H键的键能,所以
C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,故答案为:C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②键能越大形成的化学键越稳定,CC-H键的键能大于Si-H键的键能,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键;
(6)Si原子形成四个σ键,Si原子的杂化形式为sp3,根据图片知,每个三角锥结构中Si原子是1个,O原子个数=2+2×$\frac{1}{2}$=3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n- (或SiO32-),
故答案为:sp3;1:3;[SiO3]n2n- (或SiO32-).
点评 本题以硅及其化合物为载体考查了晶胞的计算、键能、原子结构等知识点,这些知识点都是考试热点,熟练掌握并灵活运用基础知识解答问题,利用均摊法计算晶胞,注意硅原子3p轨道有一个空轨道,但计算轨道数时要算上空轨道,为易错点.

| A. | 海洋约占地球表面积的71%,所以地球上不缺水 | |
| B. | 海水淡化蒸馏法的成本最低 | |
| C. | 海水淡化的主要方法有蒸馏法、电渗析法和离子交换法等 | |
| D. | 以上说法都正确 |
| A. | 苯中混有溴,加入KI 溶液,振荡,用 CCl4萃取出溴 | |
| B. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓 HNO3 和浓 H2SO4,将其倒入到 NaOH 溶液中,静置,分液 | |
| D. | 乙烯中混有 SO2,将其通入酸性 KMnO4 溶液中洗气 |
| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁、铝 | D. | 烧碱、氢气 |
| A. | 碘水,变蓝色;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色 | |
| B. | 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色 | |
| C. | 新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 | |
| D. | 碘水,变蓝色; 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀 |
| A. | 大于0.2mol•L-1 | B. | 等于0.2mol•L-1 | C. | 小于0.2mol•L-1 | D. | 无法估算 |
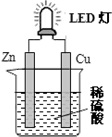
| A. | 锌片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将硫酸换成柠檬汁,导线中就不会有电子流动 | |
| D. | 如果将铜片换成锌片,LED灯仍然会发光 |

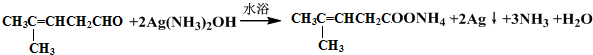
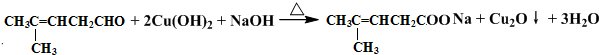 ;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是
;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是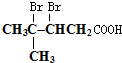 .
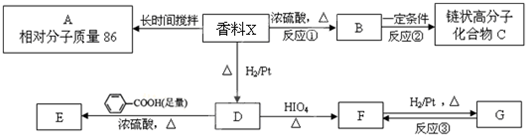
.

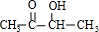 、C
、C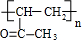 ;
;

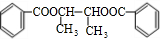 +2H2O.
+2H2O.