题目内容
4.鉴别淀粉、蛋白质、葡萄糖水溶液,依次可分别使用的试剂和对应的现象正确的是( )| A. | 碘水,变蓝色;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色 | |
| B. | 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色 | |
| C. | 新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 | |
| D. | 碘水,变蓝色; 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀 |
分析 淀粉遇碘单质变蓝,可利用碘水来鉴别淀粉,蛋白质遇浓硝酸变黄,葡萄糖溶液在碱性条件下与新制Cu(OH)2悬浊液共热生成砖红色沉淀,以此解答该题.
解答 解:因淀粉遇碘单质变蓝,可利用碘水来鉴别;
蛋白质遇浓硝酸变黄,可用浓硝酸鉴别;
葡萄糖溶液在碱性条件下与新制Cu(OH)2悬浊液共热生成砖红色沉淀.
故选D.
点评 本题考查有机物的检验和鉴别,为高频考点,侧重于学生的分析、实验和评价能力的考查,注意把握物质的性质的异同以及特征反应现象,难度不大.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
14.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
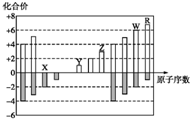

| A. | 离子原子半径:X2->Y+>Z3+ | |
| B. | 气态氢化物的沸点:X>R | |
| C. | 最高价氧化物的水化物的酸性:W>R | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
15.下列有关化学用语使用正确的是( )
①甲基的电子式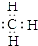 ;②Cl-的结构示意图:
;②Cl-的结构示意图: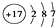 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: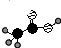 ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: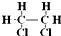
①甲基的电子式
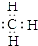 ;②Cl-的结构示意图:
;②Cl-的结构示意图: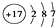 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: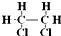
| A. | ④ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ①③④⑤⑥ |
12.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).
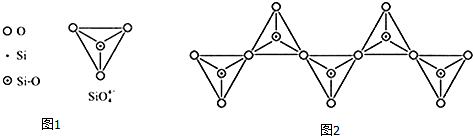
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).

19.下列说法错误的是( )
| A. | 硝酸可以使蛋白质变黄,称为颜色反应,该过程为物理变化 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 酯化反应是可逆反应,为了提高反应速率,一般加入浓硫酸做催化剂 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
9.等电子体之间结构相似、物理性质也相近.根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是( )
| A. | CO32-和NO3- | B. | O3和SO2 | C. | CO2和NO2- | D. | SCN-和N3- |
16.常温下,下列叙述正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,混合液的pH>7 | |
| D. | a1mLb1mol•L-1盐酸和a2mLb2mol•L-1氨水混合至中性,b1=b2,则a1<a2 |
8.下列物质中不属于合成材料是( )
| A. | 玻璃 | B. | 塑料 | C. | 合成橡胶 | D. | 合成纤维 |