题目内容
16.LED灯既能节能、亮度又好.图是某课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )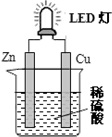
| A. | 锌片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将硫酸换成柠檬汁,导线中就不会有电子流动 | |
| D. | 如果将铜片换成锌片,LED灯仍然会发光 |
分析 装置图形成的是原电池反应,锌做负极失电子被氧化,溶液中氢离子在铜电极上得到电子生成氢气,化学能转化为电能,
A.铜锌原电池中,活泼的金属锌做负极,Cu作正极;
B.图中能量转化是化学能转化为电能,灯泡发光是电能转化为光能;
C.柠檬汁显酸性也能作电解质溶液;
D.活泼性相同的金属做原电池的电极,形成闭合回路时不能形成电势差.
解答 解:A.铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,故A错误;
B.原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故B正确;
C.柠檬汁显酸性也能作电解质溶液,所以将硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流到,故C错误;
D.如果将铜片换成锌片,两个电极都是锌电极,活泼性相同不能产生电势差,不能形成电子流向,所以LED灯不会发光,故D错误;
故选B.
点评 本题考查了原电池原理,明确正负极的判断方法以及能量的转化即可解答,可以从原电池形成的条件、电子流向、电极上得失电子、电极上发生反应类型来判断正负极,题目难度不大.

练习册系列答案
相关题目
12.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
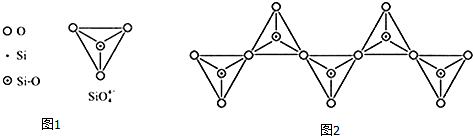
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).

4.下列对盐析和变性的说法不正确的是( )
| A. | 蛋白质的盐析是可逆过程 | |
| B. | 变性是蛋白质的凝固 | |
| C. | 盐析和变性都能够改变蛋白质的性质 | |
| D. | 盐析和变性都可以通过加入盐来实现 |
11.用于2008年北京奥运会的国家游泳中心(水立方)建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯.下列说法错误的是( )
| A. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为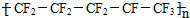 | |
| D. | 四氟乙烯中所有原子均在同一平面内 |
1.下列有关有机物的说法中正确的是( )
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 蛋自质和纤维素水解的最终产物都是氨基酸 | |
| C. | 油脂、纤维素、淀粉在一定条件下均可发生水解反应 | |
| D. | 油脂、纤维素、淀粉都是高分子化合物 |
8.下列物质中不属于合成材料是( )
| A. | 玻璃 | B. | 塑料 | C. | 合成橡胶 | D. | 合成纤维 |
5.类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列各说法中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VIIA族元素氢化物沸点顺序也是:HBr>HCl>HF | |
| B. | CH4是正四面体结构,则SiH4也是正四面体结构 | |
| C. | 锂与氧气反应:4Li+O2$\frac{\underline{\;加热\;}}{\;}$2 Li2O,则钠与氧气反应:4Na+O2$\frac{\underline{\;加热\;}}{\;}$2Na2O | |
| D. | CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2 |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1molNa与乙醇完全反应,失去2NA电子 | |
| B. | 常温常压下,8gCH4含有5NA个电子 | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA | |
| D. | 标准状况下,22.4L苯含有NA个C6H6分子 |