题目内容
7.许多国家十分重视海水资源综合利用.下列不需要化学变化就能够从海水中获得的物质是( )| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁、铝 | D. | 烧碱、氢气 |
分析 根据从海水制备物质的原理可知,金属单质与非金属单质需要利于化学反应来制取,而食盐可利用蒸发原理,淡水利于蒸馏原理来得到.
解答 解:A.把海水用蒸馏等方法可以得到淡水,把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故A正确;
B.可从海水中获得氯化钠,通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故B错误;
C.可从海水中获得氯化钠,电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故C错误;
D.可从海水中获得氯化钠,配制成饱和食盐水,然后电解得烧碱、氢气和氯气,是化学变化,故D错误;
故选A.
点评 本题考查了海水的成分,海水提炼氯气、溴、碘、钠、镁、氢气等物质的原理,题目难度不大,掌握原理是解题的关键.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
15.下列有关化学用语使用正确的是( )
①甲基的电子式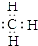 ;②Cl-的结构示意图:
;②Cl-的结构示意图: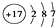 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: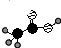 ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: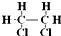
①甲基的电子式
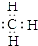 ;②Cl-的结构示意图:
;②Cl-的结构示意图: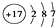 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: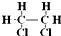
| A. | ④ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ①③④⑤⑥ |
12.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).
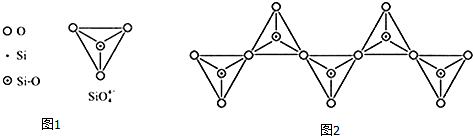
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).

19.下列说法错误的是( )
| A. | 硝酸可以使蛋白质变黄,称为颜色反应,该过程为物理变化 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 酯化反应是可逆反应,为了提高反应速率,一般加入浓硫酸做催化剂 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
16.常温下,下列叙述正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,混合液的pH>7 | |
| D. | a1mLb1mol•L-1盐酸和a2mLb2mol•L-1氨水混合至中性,b1=b2,则a1<a2 |
11.用于2008年北京奥运会的国家游泳中心(水立方)建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯.下列说法错误的是( )
| A. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为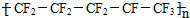 | |
| D. | 四氟乙烯中所有原子均在同一平面内 |
 .
.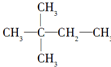 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.