题目内容
3.某醛的结构简式为
检验分子中醛基的所用的试剂是稀氨水、AgNO3溶液或新制Cu(OH)2,化学方程式为
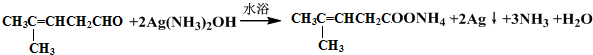
或
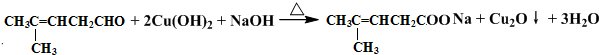 ;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是
;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是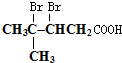 .
.
分析  含有碳碳双键,可发生加成反应,含有醛基,可发生加成、氧化反应,以此解答该题.
含有碳碳双键,可发生加成反应,含有醛基,可发生加成、氧化反应,以此解答该题.
解答 解:检验醛基,可用弱氧化剂进行氧化,加入银氨溶液后,水浴加热有银镜生成,可证明有醛基,或加入新制氢氧化铜进行加热,反应方程式为: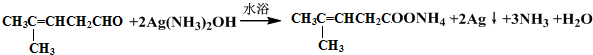 或
或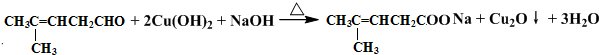 ;检验碳碳双键,可用溴水,但醛基也可与溴水发生氧化反应而使溴水褪色,则应先加入银氨溶液氧化-CHO后,调pH至酸性再加入溴水,看是否褪色,反应的方程式为
;检验碳碳双键,可用溴水,但醛基也可与溴水发生氧化反应而使溴水褪色,则应先加入银氨溶液氧化-CHO后,调pH至酸性再加入溴水,看是否褪色,反应的方程式为 ,
,
故答案为:稀氨水、AgNO3溶液或新制Cu(OH)2;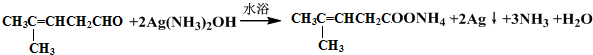
或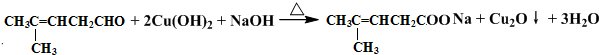 ;
;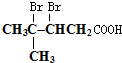 .
.
点评 本题考查有机物的结构与性质及化学实验方案的评价,为高考高频考点,把握官能团及性质的关系为解答的关键,侧重醛和烯烃的性质的考查,题目难度不大.

练习册系列答案
相关题目
13.热化学方程式中化学式前的化学计量数表示( )
| A. | 分子个数 | B. | 物质的量 | C. | 物质的质量 | D. | 原子个数 |
14.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
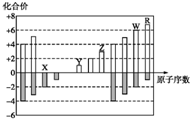

| A. | 离子原子半径:X2->Y+>Z3+ | |
| B. | 气态氢化物的沸点:X>R | |
| C. | 最高价氧化物的水化物的酸性:W>R | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
11.甲苯的一氯代物共有( )种.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.下列说法不正确的是( )
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
8. 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成,第二,反应放出热量.Na2O2跟水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论,用以验证第一条结论的实验操作是:打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成.
(3)已知Na2O2跟足量水充分反应生成的溶液中有H2O2存在.实验(2)往试管(如图)中加入水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,现象是:溶液先变红后褪色.
(4)称取3.9g Na2O2固体,加入50g水中充分反应,所得溶液的质量分数为7.5%.
(5)H2O2不稳定会分解,CuSO4溶液对过氧化分解有催化作用,有同学猜想起催化作用的是Cu2+,请你根据以下实验条件,用实验证明该同学的猜想正确.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、酒精灯、药匙、木条;酚酞试液、2mol/L 盐酸、2mol/L硫酸溶液、2mol/L硝酸溶液、5%的H2O2溶液、CuSO4溶液、蒸馏水.
 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成,第二,反应放出热量.Na2O2跟水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论,用以验证第一条结论的实验操作是:打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成.
(3)已知Na2O2跟足量水充分反应生成的溶液中有H2O2存在.实验(2)往试管(如图)中加入水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,现象是:溶液先变红后褪色.
(4)称取3.9g Na2O2固体,加入50g水中充分反应,所得溶液的质量分数为7.5%.
(5)H2O2不稳定会分解,CuSO4溶液对过氧化分解有催化作用,有同学猜想起催化作用的是Cu2+,请你根据以下实验条件,用实验证明该同学的猜想正确.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、酒精灯、药匙、木条;酚酞试液、2mol/L 盐酸、2mol/L硫酸溶液、2mol/L硝酸溶液、5%的H2O2溶液、CuSO4溶液、蒸馏水.
| 假设 | 实验操作 | 预期现象 | 结论 |
| 起催化作用的是CuSO4溶液中的SO42- | 向盛有2mL5%的H2O2溶液的试管中滴加入少量的2mol/LH2SO4溶液,并把带火星的木条伸入试管. | 无明显现象 | 起催化作用的不是SO42- |
| 起催化作用的是CuSO4溶液中的Cu2+ | 向盛有2mL5%的H2O2溶液的试管中滴加入少量的CuSO4溶液,并把带火星的木条伸入试管. | 试管中有大量气泡产生,带火星的木条复燃 | 起催化作用的是Cu2+ |
15.下列有关化学用语使用正确的是( )
①甲基的电子式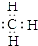 ;②Cl-的结构示意图:
;②Cl-的结构示意图: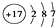 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: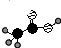 ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: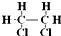
①甲基的电子式
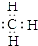 ;②Cl-的结构示意图:
;②Cl-的结构示意图: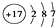 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: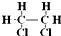
| A. | ④ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ①③④⑤⑥ |
12.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).
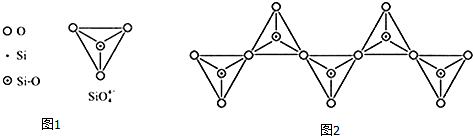
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO4-4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为[SiO3]n2n-(或SiO32-).
