题目内容
7.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.35mol/L,下列有关判断正确的是( )| A. | x+y<z | B. | 平衡正向移动 | C. | B的浓度增大 | D. | A的转化率降低 |
分析 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,若平衡不移动,A的浓度为0.25mol.L,而平衡时测得A的浓度变为0.35mol/L,可知体积增大、压强减小,平衡逆向移动,以此来解答.
解答 解:A.减小压强,平衡逆向移动,则x+y>z,故A错误;
B.由上述分析可知,平衡逆向移动,故B错误;
C.因体积增大,B的浓度小于原平衡的浓度,故C错误;
D.平衡逆向移动,A的转化率降低,故D正确;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握体积与压强的关系、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意动态变化与静态变化的结合,题目难度不大.

练习册系列答案
相关题目
2.下列解释事实的方程式不正确的是( )
| A. | 空气中加热钠生成淡黄色固体:2Na+O2$\frac{\underline{\;△\;}}{\;}$Na2O2 | |
| B. | 铁与水蒸气反应生成黑色固体:3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| C. | 除去乙炔中的H2S气体:H2S+Cu2+═CuS↓+2H+ | |
| D. | 实验室制备氨气:NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
18.某溶液中,若忽略水的电离,只含有表中所示的四种离子,试推测X离子及其物质的量b可能为( )
| 离子 | Na+ | Al3+ | Cl- | X |
| 物质的量 | 2a | a | a | b |
| A. | NO3-、2a | B. | CO32-、2a | C. | OH-、4a | D. | SO42-、2a |
15.下列反应的离子方程式书写正确的是( )
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| B. | 漂白粉的稀溶液中通入过量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 用FeC1 溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 含有a mol FeBr2的溶液中,通入 a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- |
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(Fe3+)=0.1mol/L的溶液中:K+、Mg2+、SCN-、SO42- | |
| B. | c(H+)=1mol/L的溶液中:Cu2+、Na+、ClO-、S2- | |
| C. | 能使酚酞变红的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | pH=2的溶液中:Na+、Ag+、I-、NO3- |
12.下列物质是电解质的是( )
| A. | 铜 | B. | 酒精 | C. | 硫酸溶液 | D. | 硫酸钡 |
19.下列叙述中不正确的是( )
| A. |  可用装置鉴别碳酸钠和碳酸氢钠 | |
| B. | 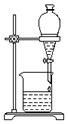 可用装置分离汽油和水的混合物 | |
| C. | 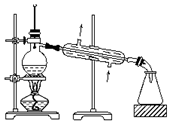 可用装置从海水中蒸馏得到淡水 | |
| D. | 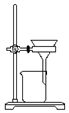 可用装置把胶体粒子从分散系中分离出来 |
16.某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将镁蒸气在氮气中冷却得到镁粉 |
4.2A(g)?2B(g)+C(g);△H>0,达平衡时,要使v正降低、c(A)增大,应采取( )
| A. | 加压 | B. | 减压 | C. | 减少A | D. | 降温 |