题目内容
4.硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂.[查阅资料]隔绝空气加热至500℃时硫酸亚铁能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等.
[实验探究]某化学小组选用如图所示部分装置迸行实验(夹持装备略)
实验I验证分解产物中含有氨气和水蒸气,并探究残留固体成分.
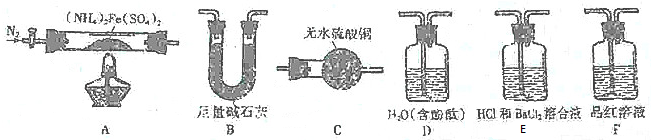
(1)所选用装置的正确连接顺序为ACBD(填装置的字母序号).
(2)证明有水蒸气生成的实验现象为C中无水硫酸铜变蓝色.
(3)证明有氨气生成的实验现象为D中溶液变红色.
(4)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4.
实验Ⅱ乙同学为探究分解产物中的硫氰化物,连接装置A-E-F-B进行实验.
(5)实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是分解产物中有SO2没有SO3.
(6)B的作用是吸收SO2防止污染空气.
(7)实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2产生,写出A中反应的化学方程式2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O.
分析 (1)实验I验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中含氨气;
(2)证明水蒸气生成是利用无水硫酸铜遇到水变蓝色;
(3)证明有氨气生成是利用氨气极易溶于水生成一水合氨溶液显碱性使酚酞变红色;
(4)设计实验利用亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计;
(5)E中没有明显现象,说明无三氧化硫生成,F中溶液褪色说明有二氧化硫生成;
(6)最后装置B是防止二氧化硫污染空气;
(7)实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平书写化学方程式.
解答 解:(1)实验I验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中含氨气,所选用装置的正确连接顺序为ACBD,
故答案为:ACBD;
(2)利用无水硫酸铜遇到水变蓝色证明水蒸气生成,证明有水蒸气生成的实验现象为C中无水硫酸铜变蓝色,
故答案为:C中无水硫酸铜变蓝色;
(3)证明有氨气生成是利用氨气极易溶于水生成一水合氨,溶液显碱性使酚酞变红色,证明有氨气生成的实验现象为D中溶液变红色,
故答案为:D中溶液变红色;
(4)设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4,设计实验利用亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计,取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4,
故答案为:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4;
(5)E中含HCl的BaCl2溶液没有明显现象,说明无硫酸钡沉淀生成,证明分解产物中无三氧化硫生成,二氧化硫具有漂白性能使品红溶液褪色,F中溶液褪色说明有二氧化硫生成,
故答案为:分解产物中有SO2没有SO3;
(6)连接装置A-E-F-B进行实验,最后装置B是防止二氧化硫污染空气,
故答案为:吸收SO2防止污染空气;
(7)实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平书写化学方程式为:2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O,
故答案为:2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O.
点评 本题考查了物质组成的实验探究和实验设计,主要是实验基本操作、物质性质的理解应用,掌握基础是解题关键,题目难度中等.

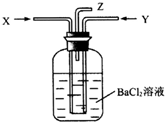 碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 在Z导管出来的气体中无二氧化碳 | ||
| C. | 在Z导管口不会出现红棕色气体 | D. | 洗气瓶中产生的沉淀是硫酸钡 |
| A. | HCl的水溶液是强酸,HBr的水溶液也是强酸 | |
| B. | CO2气体通入Ba(NO3)2溶液中不反应,SO2气体通入Ba(NO3)2溶液中也不反应 | |
| C. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |
| A. | NH3 | B. | H2O | C. | Ca2+ | D. | CO |
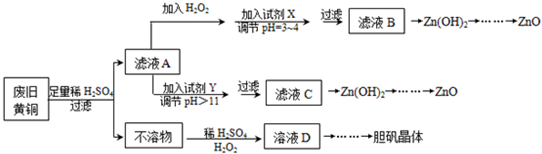
已知:①Zn及化合物性质与Al及化合物性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.
②下表为几种离子生成氢氧化物沉淀的pH(开始沉淀时金属离子浓度为1.0mol•L-1).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(2)调节pH=3~4的试剂X可以用AC:
A.ZnO B.NaOH C.Zn(OH)2 D.ZnSO4
调节pH=3~4的目的是使Fe3+转化为Fe(OH)3,达到除去Fe3+的目的.
(3)往滤液A中加的Y试剂可以是B:
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
(4)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤、晾干.
(6)测定胆矾晶体纯度(不含能与I-反应的杂质):准确称取0.5000g胆矾晶体置于锥形瓶,加适量水溶解,再加过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.60mL,离子反应为:
2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为98.00%.
②若滴定前仰视、滴定后俯视滴定管读数,所测纯度将会偏低(填“偏高”、“偏低”或“不变”).
 某研究性学习小组对铁生锈进行研究.
某研究性学习小组对铁生锈进行研究.