题目内容
15.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列各说法中,正确的是( )| A. | HCl的水溶液是强酸,HBr的水溶液也是强酸 | |
| B. | CO2气体通入Ba(NO3)2溶液中不反应,SO2气体通入Ba(NO3)2溶液中也不反应 | |
| C. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
分析 A.H-Br键比H-Cl更易断裂,HCl为强酸;
B.SO2气体通入Ba(NO3)2溶液中发生氧化还原反应;
C.S的氧化性很弱;
D.CaSO3与稀硝酸发生氧化还原反应生成硫酸钙.
解答 解:A.H-Br键比H-Cl更易断裂,HCl为强酸,可知氢溴酸为强酸,故A正确;
B.CO2与Ba(NO3)2溶液不反应,符合强酸制弱酸的原理,而SO2为强还原性物质,Ba(NO3)2溶液中含有NO3-,酸性条件下将SO2氧化成SO42-,反应生成BaSO4,故B错误;
C.S与Cu反应生成Cu2S而不是CuS,故C错误;
D.CaSO3与稀硝酸发生氧化还原反应,不生成SO2,而生成BaSO4,NO等物质,故D错误;
故选A.
点评 本题考查化学反应的规律,为高频考点,把握物质的性质、反应原理为解答的关键,注意类比规律应用及物质特定条件下的性质,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
5.X、Y、Z 3种元素位于周期表中的同一周期,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则3种元素的原子序数的大小顺序是( )
| A. | X>Y>Z | B. | Y>Z>X | C. | X>Z>Y | D. | Z>X>Y |
6.阿伏加德罗常数用NA表示,下列说法中正确的是( )
| A. | 1 mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 标准状况下,22.4L溴单质所含原子数目为2NA | |
| C. | 密闭容器盛有0.1molN2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6NA | |
| D. | 常温常压下,100mL lmol.L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA |
3.下列事实中能证明碳的非金属性比硅强的是( )
①往Na2SiO3溶液中通入CO2产生白色沉淀
②石墨是导体,晶体硅是半导体
③制玻璃过程中发生反应Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
④CH4比SiH4稳定.
①往Na2SiO3溶液中通入CO2产生白色沉淀
②石墨是导体,晶体硅是半导体
③制玻璃过程中发生反应Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
④CH4比SiH4稳定.
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①② |
10.下列各组物质,前者逐滴滴加(或逐渐通入)到后者中直至过量,没有出现“先有白色沉淀,后来沉淀又完全消失”现象的是( )
| A. | 盐酸滴入NaAlO2溶液中 | B. | CO2气体通入漂白粉溶液中 | ||
| C. | NaOH溶液滴入AlCl3溶液中 | D. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 |
20.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(+283.0)kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
7.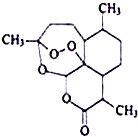 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素易溶于苯,难溶于水 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素的同分异构体不可能有芳香族化合物 |
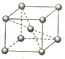 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.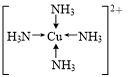 (写在方框内).
(写在方框内).