题目内容
16.下列分子或离子中不能跟质子结合的是( )| A. | NH3 | B. | H2O | C. | Ca2+ | D. | CO |
分析 质子含有空轨道,含有空轨道的原子和含有孤电子对的原子之间能形成配位键,分子或离子中不能跟质子结合,说明该分子或离子中中心原子不含孤电子对,据此分析解答.
解答 解:A.氨气分子中N原子含有孤电子对,能和质子结合形成NH4+,故A不选;
B.H2O分子中O原子含有孤电子对,能和质子结合形成H3O+,故B不选;
C.Ca2+带正电荷,不能和质子结合,故C选;
D.CO不能和质子结合,故D选;
故选CD.
点评 本题考查化学键,明确配位键形成条件是解本题关键,注意理解结合质子的微粒的结构特点,难度不大.

练习册系列答案
相关题目
6.阿伏加德罗常数用NA表示,下列说法中正确的是( )
| A. | 1 mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 标准状况下,22.4L溴单质所含原子数目为2NA | |
| C. | 密闭容器盛有0.1molN2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6NA | |
| D. | 常温常压下,100mL lmol.L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA |
7.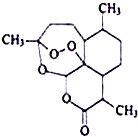 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素易溶于苯,难溶于水 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素的同分异构体不可能有芳香族化合物 |
11.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 原子半径由大判小的顺序;Z>R>Y>W | |
| B. | X与Y形成化合物中一定含有离子键,可能含有共价键 | |
| C. | Y的氢化物比R的氢化物稳定,但Y的氢化物比R的氢化物熔沸点低 | |
| D. | RY2、WY2通入BaCl2溶液中均有白色沉淀生成. |
5.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:
下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡时v(正)>v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
12.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:①2Fe2++H2O2+2H+═2Fe3++2H2O,②2Fe3++H2O2═2Fe2++O2↑+2H+.下列说法不正确的是( )
| A. | 由反应①知H2O2的氧化性比Fe3+强,由反应②知H2O2的还原性比Fe2+强 | |
| B. | 在反应①、②中H2O2均作氧化剂被还原 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
10.下列不属于我国“城市空气质量日报”报道内容的是( )
| A. | SO2 | B. | CO2 | C. | PM2.5 | D. | 空气质量等级 |
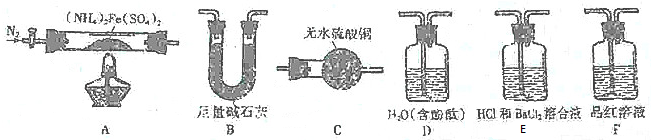
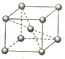 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.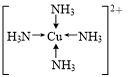 (写在方框内).
(写在方框内).