题目内容
14. 2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.
2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.(1)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为2H2+O2═2H2O,电解液为KOH溶液,反应保持在较高温度使H2O蒸发.下列叙述正确的是D.
A.此电池能发出蓝色火焰
B.H2为正极,O2为负极
C.工作时,电解液的pH不断减小
D.负极的电极反应为2H2+4OH--4e-═4H2O,
正极的电极反应为O2+2H2O+4e-═4OH-
(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得
常温下1L水,则电池内电子转移的物质的量约为1.1×102 mol.
(3)由美国西屋公司研制开发的固体氧化物燃料电池,以固体氧化铝-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.
该电池a极对应的电极反应式为O2+4e-═2O2-,电池总反应方程式为2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O.
分析 (1)该燃料电池是将化学能转化为电能,负极上电极反应式为2H2+4OH--4e-=4H2O、正极反应式为O2+2H2O+4e-=4OH-,电池反应式为2H2+O2=2H2O,结合溶液中KOH是否浓度变化分析解答;
(2)根据电池反应式中水和转移电子的关系计算;
(3)该电池属于固体燃料电池,以固体氧化锆-氧化钇为电解质,电池工作时,正极上氧气得电子生成氧离子;负极为氢气失电子发生氧化反应生成水.
解答 解:(1)A.该电池中燃料不燃烧,是直接将化学能转化为电能,所以不能发出蓝色火焰,故A错误;
B.放电时反应过程中生成水,但反应保持在较高温度,使H2O蒸发,所以KOH浓度不变,则溶液的pH不变,故B错误;
C.通入氢气的电极为负极,通入氧气的电极为正极,故C错误;
D.负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子,所以负极:2H2+4OH--4e-=4H2O,正极:O2+2H2O+4e-=4OH-,故D正确;
故答案为:D;
(2)1L水的质量为1000g,水的物质的量为n=$\frac{m}{M}$=$\frac{1000g}{18g/mol}$=$\frac{500}{9}$mol,
负极:2H2-4e-+4OH-=4H2O ①
正极:O2+2H2O+4e-=4OH-②
①+②得:2H2+O2=2H2O~~~~转移电子
2mol 4mol
$\frac{500}{9}$mol 1.1×102 mol
故答案为:1.1×102 mol;
(3)该电池属于固体燃料电池,以固体氧化锆-氧化钇为电解质,电池工作时,正极上氧气得电子生成氧离子,则正极的反应式为O2+4e-═2O2-;负极为氢气失电子发生氧化反应生成水,则负极电极方程式为:2H2-4e-+2O2-═2H2O,正负极反应式相加可得总反应为:2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O;
故答案为:O2+4e-═2O2-;2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O.
点评 本题考查燃料电池,明确正负极上发生的反应以及电极方程式的书写方法是解本题关键,侧重于考查学生的分析能力和计算能力,注意把握电子守恒在计算中的应用,题目难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得
CH3OH的浓度为0.2mol/L.下列判断不正确的是bcd
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+4e-+2H2O=4OH-.

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于1.4×10-5mol/L.
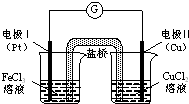
| A. | 电极Ⅰ上发生还原反应,作原电池的正极 | |
| B. | 电极Ⅱ的电极反应式为:Cu-2e-═Cu2+ | |
| C. | 该原电池的总反应为:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
| A. | 一定条件下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| B. | 标准状况下,2.24L氖气所含原子数为0.2NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数2 NA | |
| D. | 5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA |

根据以上规律判断,下列结论正确的是( )
| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | ||
| C. | 反应Ⅱ:△H>0,T1>T2 | D. | 反应Ⅳ:△H<0,T2>T1 |
 (NH3·H2O)+c(NH3)=0.1mol·L-1
(NH3·H2O)+c(NH3)=0.1mol·L-1 原氨水中:c(NH4+)+c(H+)=c(OH-)
原氨水中:c(NH4+)+c(H+)=c(OH-)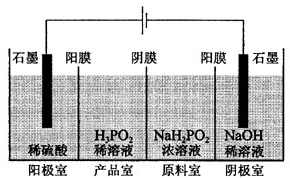 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: